Введение
Вопросы экологической и технологической безопасности различных производств в настоящее время активно обсуждаются [1,2]. Производство метанола является крайне опасным как для окружающей природной среды, так и для работающих на производстве и обслуживающих технологический процесс. Метанол является одним из важнейших многотоннажных продуктов, отпускаемых современной химической промышленностью. Он широко применяется для получения пластических масс, синтетических волокон, синтетического каучука, в качестве растворителя. Одним из способов получения метанола является синтез из оксида углерода (II) и водорода. Процесс выполняется под давлением и увеличенной температурой в специальном аппарате – колонне синтеза метанола. Цель работы заключается в изучении производства метанола. При исследовании производства необходимо охарактеризовать целевой продукт, исходное сырье, рассмотреть и описать технологический процесс получения метанола из оксида углерода и водорода, описать основное технологическое оборудование, рассчитать тепловой и материальный балансы, изучить вопросы охраны труда и окружающей среды.
Характеристика исходного сырья и целевого продукта
Данная работа посвящена изучению производства метанола из оксида углерода и водорода. Дана характеристика процесса производства метанола. Произведена характеристика целевого продукта.
Метанол СН3ОН – это простейший представитель предельных спиртов с одной гидроксогруппой. В свободном состоянии в природе не распространен, содержится в виде производных в растительных маслах, природных красителях. Представляет собой при нормальных условиях бесцветную, легколетучую, горючую жидкость, иногда с запахом, напоминающий запах этилового спирта. Метанол на организм человека действует опьяняющим образом и является сильным ядом, вызывающим потерю зрения и, в зависимости от дозы, смерть.
Охарактеризовано исходное сырье. Исходным сырьем является оксид углерода и водород. Оксид углерода (II) представляет собой бесцветный газ без вкуса и запаха. Водород - это самый простой, самый лёгкий, самый распространённый элемент. На его долю приходится около 88,6 % всех атомов. Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия.
Рассмотрено и описано основное технологическое оборудование, и технологический процесс производства метанола из оксида углерода (II) и водорода [3].
Исходный газ для синтеза метанола можно получить почти из всех видов сырья, которые используют при получении водорода, например в процессах синтеза аммиака, и гидрирования жиров. Поэтому производство метанола может базироваться на тех же сырьевых ресурсах, что и производство аммиака. Использование того или иного вида сырья для синтеза метанола определяется рядом факторов, но прежде всего его запасами и себестоимостью в выбранной точке строительства. Процесс синтеза метанола характеризуется следующими основными реакциями:
СО + 2Н2 = СН3ОН + Q (1)
СО + 3Н2 = СН4 + Н2О (2)
2СО + 2Н2 = СН4 + СО2 (3)
2СО = СО2+ С (4)
СО + Н2 = НСНО (5)
2СН3ОН = (СН3)2О + Н2О (6)
СН3ОН + Н2 = СН4 + Н2О (7)
Технологический процесс и оборудование
Рассмотрен и описан технологический процесс получения метанола. Основное технологическое оборудование производства метилового спирта из окиси углерода и водорода: колонна синтеза и теплообменник. Колонны обычно изготавливают из высоколегированной стали, хорошо сопротивляющейся коррозионному действию Н2 и СО, или из низколегированных конструкционных сталей с футеровкой стенок медью или ее сплавами. Производительность колонны синтеза метанола в большой степени зависит от конструкции насадки. Теплообменником называют специальное устройство для передачи тепловой энергии от теплого носителя к холодному. Теплоносителем может выступать как жидкая субстанция, так и газообразная [4]. Процесс теплообмена важен в таких отраслях промышленности как химическая, энергетическая, металлургическая, пищевая и другие. Теплообменное устройство, способствует передаче энергии от одного носителя к другому через разделительную стенку между ними. Это очень сложный процесс, разделяющийся по принятым канонам на такие виды теплообмена: конвекцию, тепловое излучение и теплопроводность. Эти процессы протекают одновременно в определенных пропорциях. Наибольшую важность для теплообменника имеет конвективный теплообмен, т.е совместное действие конвекции с теплопроводностью.
Расчет материального и теплового баланса
В ходе работы произвели практический расчет материального баланса. По следующим исходным данным: рабочий объем катализатора, Vкат– 22м3, расход окиси углерода и метанола на побочные продукты: СО: реакция 2 – 3,6 , реакция 3 – 3,9 , реакция 4 – 2,3, реакция 5 – 0,5. СН3О: реакция 6 – 1,7, реакция 7 – 0,3, температура, Т = 641 К, давление, Р = 34,5 МПа, объемная скорость 26,6•103 нм, мольное соотношение Н2 : СО = 6,2 : 1. Рассчитали количества прихода и расхода веществ производства метанола.
Рассчитывался объем газа для проведения процесса в условиях колонны синтеза по формуле:
V = p0V0T/pT0,
где р, V –давление, объем при данной температуре Т; р0, V0 – давление и объем при нормальных условиях.
Объем синтез - газа рассчитывали, учитывая объём катализатора. Рассчитывали количество молей и массовый расход исходного угарного газа и водорода на целевую и побочные реакции.
Примеры расчетов:
Образующийся объем газа в условиях реактора:
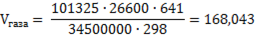 м
м
Количество молей водорода и оксида углерода содержится:
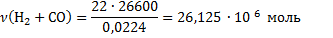
Количество молей Н2:
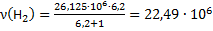 моль/ч
моль/ч
Количество молей СО:
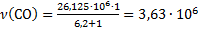 моль/ч
моль/ч
Массовый расход Н2:
m (H2) = 22,49 · 106 · 2 = 44,98 · 106 г/ч = 44,98 · 103 кг/ч
Массовый расход СО:
m (CO) = 3,63 · 106 · 28 = 101 · 106 г/ч = 101 · 103 кг/ч
Расход водорода по реакции (1):
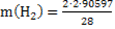 =12942кг/ч
=12942кг/ч
Расход водорода по реакции (2):
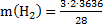 =779,1кг/ч
=779,1кг/ч
Получено метана по реакции (2):
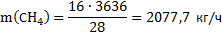
Получено воды по реакции (2):
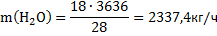
Аналогичные расчеты проведены по реакциям 3,4,5,6,7.
Всего образовалось:
∑ СО2= 3094,4+1825,2=4920,1
∑ Н2О = 2337,4+ 174,7+495,045= 3007,145
∑ СН4= 155,3+1125,4+2077,7= 3358,4
Данные расчета материального баланса производства представлены в сводной таблице.
Таблица 1 – Материальный баланс по метанолу.
|
Приход |
кг/ч |
т/сут |
Расход |
кг/ч |
т/сут |
|
Синтез - газ, в т. ч. Н2 СО |
44980 101000 |
1079,52 2424 |
СН3ОН (СН3)2О Н2О СН4 СО2 НСНОС Н2 |
101468,2 1265 3007,1 3358,4 4920,1 541,1 497,8 30922 |
2435,24 30,36 72,17 80,60 118,08 12,99 11,95 742,128 |
|
ИТОГО |
145980 |
3503,52 |
ИТОГО |
145980 |
3503,52 |
Сделан расчет теплового баланса синтеза метанола. Исходными данными служат: количество газовой смеси на входе в реактор синтеза 272,21 м3/с, количество газовой смеси на выходе из реактора синтеза 260,53 м3/с, температура: газовой смеси на входе в реактор, °С – 200; газовой смеси на выходе из реактора, °С - 220; холодной (байпасной) газовой смеси, °С – 35, расход холодного газа составляет 50% от поступающего в реактор газа. Рассчитаны теплоемкости смеси при данных температурах, количество газовой смеси на входе и выходе.
Данные расчета теплового баланса производства представлены в сводной таблице.
Таблица 2 – Тепловой баланс реактора синтеза.
|
Приход |
кВт |
% |
Расход |
кВт |
% |
|
Тепловой поток газовой смеси на входе |
41827,11 |
48,0 |
Тепловой поток газовой смеси на выходе |
85103,69 |
95 |
|
Теплота экзотермической реакции |
45356,81 |
52,0 |
Теплопотери в окружающую среду |
2676,77 |
5 |
|
Итого |
87483,92 |
100 |
Итого |
87780,46 |
100 |
Невязка теплового баланса составляет 0,68%.
Таким образом, в работе исследовали технологический процесс производства метанола, основное технологическое оборудование, рассчитали материальный и тепловой балансы.
Охрана труда и окружающей среды
Изучили охрану труда и окружающей среды. Метанол — сильнейший яд, употребление которого приводит к тяжёлому отравлению, токсический эффект проявляется спустя некоторое время. ПДК метанола в воздухе рабочей зоны и в воздухе населенных мест составляет 1 мг/м³ [5]. Метанол, попавший в организм человека, окисляется до не менее ядовитого формальдегида, который влияет на нервную систему, в частности на ее зрительный отдел, реагирует с белками, что приводит к головной боли, общей слабости, недомоганию, ознобу, тошноте, рвоте. Помимо метанола особенно опасным веществом является используемый оксид углерода, который вызывает необратимые изменения в кровеносной и дыхательной системах. Основными источниками загрязнения атмосферного воздуха оксидом углерода (II) являются трубчатые печи технологических установок, выбросы которых составляют 50% от объёма общих выбросов; реакторы установок каталитического крекинга (12%); выхлопы газовых компрессоров (14%); битумные установки (8%) и факелы (17%). Водород является взрывоопасным веществом, что также влияет на опасность производства и требует повышенных мер предосторожности при проведении технологического процесса.
К мероприятиям по снижению степени распространения вредных веществ, относят: нейтрализацию, консервацию, захоронение и утилизацию выбросов. При рассмотрении технологических мероприятий по снижению выбросов вредных веществ их принято разбивать на группы в соответствии с тем, выбросы каких веществ они предотвращают.
Для снижения выбросов оксида углерода проводится каталитический дожиг отходящих газов и утилизация больших количеств в котлах – утилизаторах.
Таким образом, в работе исследовали технологический процесс производства метанола, основное технологическое оборудование, рассчитаны материальный и тепловой балансы, рассмотрены вопросы технологической безопасности производства.

