Введение
Основное свойство циркония
Цирконий (Zr) — элемент побочной подгруппы четвертой группы пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 40. Простое вещество цирконий — блестящий металл серебристо-серого цвета. Обладает высокой пластичностью, устойчив к коррозии.
Кристаллические структуры циркония
Существует в двух кристаллических модификациях:
• α-Zr — с гексагональной решёткой типа магния (а = 3,231 Å; с = 5,148 Å; z = 2;
пространственная группа P63/mmc)
• β-Zr — с кубической объёмно центрированной решёткой (a = 3,61 Å; z = 2;
пространственная группа Im3m).
Переход α ↔ β происходит при 863 °C, ΔH перехода 3,89 кДж/моль. Добавки Al, Sn, Pb, Cd повышают, а Fe, Cr, Ni, Mo, Cu, Ti, Mn, Co, V и Nb понижают температуру перехода[4].
Данная работа посвящена исследованию α-Zr модификации. Тип решетки- гексагональный. Для бесконечной трёхмерной решётки, характеризующейся базисными векторами, её обратная решётка задаётся тройкой базисных векторов обратной решётки(b1,b2,b3):
![]()
![]()
![]()
Прямой и обратной проведены в рис.1,
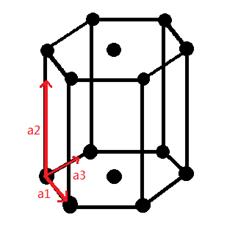
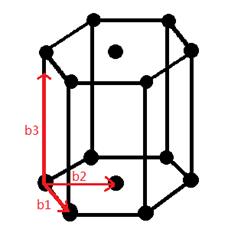
Рис.1 Прямая решетка ГЦК и соответствующая ей обратная решетка
Изоэнергетическая поверхность в пространстве квазиимпульсов называется поверхностью Ферми, соответствующая энергии-Ферми ![]() :
:
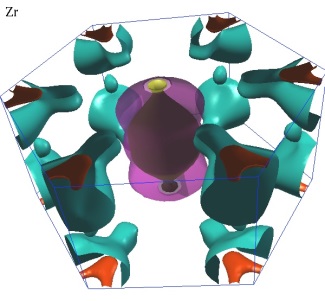
Рис.2 Поверхность Ферми циркония[3]
Свойство микро- и наноструктур циркония
Физические свойства циркония в микроструктуре представлены в табл. 1.
Таблица 1 Свойства циркония в микроструктуре
|
Свойство |
Параметры |
|
Плотность |
6,506 г/см3 |
|
Температура плавления |
2125 к |
|
Температура кипения |
4650 к |
|
Теплота плавления |
19,2 кдж/моль |
|
Теплота испарения |
567 кдж/моль |
|
Молярная теплоёмкость |
25,3 дж/(к.моль) |
|
Молярный объём |
14,1 см3/моль |
|
Температура Дебая |
291к |
|
Теплопроводность |
300к |
|
Цвет |
Серебристо-серый |
Поскольку не найдена информация о нано-структуре циркония, сравниваются свойства в микро- и нано-структурах циркония и диоксида циркония.
Свойства диоксида циркония [5]
ZrO2 (диоксид циркония), бесцветные кристаллы, tпл= 2715 °C. Оксид циркония – один из наиболее тугоплавких оксидов металлов. Диоксид циркония проявляет амфотерные свойства, нерастворим в воде и водных растворах большинства кислот и щелочей, однако растворяется в плавиковой и концентрированной серной кислотах, расплавах щелочей. Сравнительные свойства циркония в микроструктуре и нано структуре показаны в табл. 2.
Таблица 2 Сравнительные свойства диоксида циркония в микроструктуре и нано структуре
|
Свойства |
Микроструктура Zr |
Микроструктура ZrO2 |
Наноструктура ZrO2(45нм) |
|
Электропроводимость см.м-1 |
43 |
2,1 |
2,43 |
|
Температура плавления С |
1852 |
1650 |
2715 |
|
Плотность г/см^3 |
6,506 |
6,05 |
5,89 |
|
Длина свободного пробега нм |
0,6 |
17,9 |
25 |
Физические причины изменения свойств [2]
Из сравнения свойств диоксида циркония в микроструктуре и нано структуре, можно сказать, что свойства диоксида циркония изменились при изменении размеров. Температура плавления наноструктуры ZrO2 увеличилась почти на 1000 градусов Цельсия. Плотность наноструктуры ZrO2 уменьшилась на 0,16 г/см^3. Длина свободного пробега наноструктуры ZrO2 увеличилась на 7.1 нм. Электропроводимость наноструктуры ZrO2 увеличилась на 0.33 см.м^-1. Физические причины изменения свойств состоят в следующем:
1. Диоксид циркония в нано материале обладает склонностью к самоорганизации кластерных структур;
2. Большая доля атомов находится на выступах и уступах поверхности. Поэтому свободная поверхность является стоком бесконечной емкости для точечных и линейных кристаллических дефектов[2];
3. Поверхностные эффекты механических свойств;
4. Тонкие физические эффекты взаимодействия электронов со свободной поверхностью.
Размерные эффекты, влияющие на изменение свойств наноструктур по сравнению с микроструктурами разделяются на классические и квантовые. Если размеры наноструктуры сравнимы с длиной волны де Бройля, основное влияние имеют квантовые размерные эффекты. В данном случае, длина волны де Бройля равна:
![]()
Размер наноструктуры диоксида циркония равен 45нм, λ< <45нм. Поэтому квантовые размерные эффекты в рассматриваемом случае не имеют значения. Поскольку длина свободного пробега (таблица 2) сравнима с размерами наноструктуры диоксида, делаем заключение, что основное влияние на изменение свойств диоксида оказывают классические размерные эффекты.
Технологии получения циркония
Известно, что по запасам цирконий содержащего рудного сырья Украина занимает одно из ведущих мест в мире [6]. В связи с этим целесообразным является создание в стране полного цикла производства циркония.
Методы получения циркония электролизом
Данный метод известен давно, однако сложность аппаратурного оформления и значительные энергетические затраты усложняют его широкое внедрение. Промышленное применение имеют: электролиз комплексных фторидов циркония, электролиз хлоридов циркония, а также электролиз в солевых хлоридно-фторидных системах.
При получении исходного сырья для электролиза ![]() выполняют разложение циркона по реакции:
выполняют разложение циркона по реакции:
![]()
Основными реакциями процесса электролиза с использованием хлориднфторидних растворов служат нижеприведенные [1]:
![]()
![]()
Восстановление фторидов циркония кальцием. Технология получения пластичного кальциетермического циркония в промышленном масштабе Украины была освоена на ГНПП «Цирконий». Указанное производство основано на реализации кальциетермического восстановления тетрафторида циркония по реакции:
![]()
Восстановление хлоридов циркония магнием. В основе данного процесса лежит реакция:
![]()
Технология предусматривает хлорирование циркона, разделение хлоридов циркония и гафния, восстановление тетрахлорида циркония, очистку продуктов восстановления вакуумной сепарацией, вакуумную обработку губчатого циркония и его переработку на товарный продукт.
Применение циркония
Благодаря таким важным качествам, как устойчивость к коррозии, щелочам, кислотам цирконий широко применяется в разных отраслях. Так, в металлургии он используется для легирования сталей и улучшения качества сплавов. В порошкообразном виде применяется в пиротехнике и производстве боеприпасов – дистанционных бомб, трассирующих пуль, осветительных ракет.

Очищенный от гафния цирконий в виде сплавов используют в ядерных реакторах в качестве конструкционного материала. Широкое распространение получил этот металл в медицине и быту. Тонкая циркониевая пластина задерживает излучение в рентгеновском отделении намного сильнее, чем свинцовые фартуки.
Цирконий входит в состав ряда сплавов (на основе магния, титана, никеля, молибдена, ниобия и других металлов), используемых как конструкционные материалы. Новые перспективы его применения в различных областях:
1. Атомная энергетика;
2. Черная металлургия;
3. Цветная металлургия;
4. Химические и нефтеперерабатывающие промышленности;
5. Электроника и электротехника;
6. Сплавы циркония применяют в качестве конструкционных материалов в ядерных реакторах;
7. Сплавы циркония используют в качестве коррозионно – стойкого материала в химическом машиностроении.
Выводы
Исследованы свойства диоксида циркония в микроструктуре и нано структуре. Из сравнения свойств выяснились, что диоксид циркония в наноструктуре имеет особенные свойства по сравнению с микроструктурой, например, электропроводимость диоксида циркония резко уменьшилась, а его температура плавления повышилась. Особые свойства обусловливают широкое применение диоксида циркония в промышленности.

