Цирконий (Zr) — элемент побочной подгруппы четвёртой группы пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 40. Простое вещество цирконий — блестящий металл серебристо-серого цвета. Обладает высокой пластичностью, устойчив к коррозии.
Кристаллические структуры циркония
Существует в двух кристаллических модификациях:
- α-Zr — с гексагональной решёткой типа магния (а = 3,231 Å; с = 5,148 Å; z = 2; пространственная группа P63/mmc)
- β-Zr — с кубической объёмно центрированной решёткой (a = 3,61 Å; z = 2; пространственная группа Im3m).
Переход α ↔ β происходит при 863 °C, ΔH перехода 3,89 кДж/моль. Добавки Al, Sn, Pb, Cd повышают, а Fe, Cr, Ni, Mo, Cu, Ti, Mn, Co, V и Nb понижают температуру перехода [1].
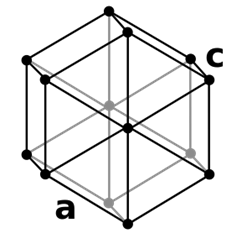
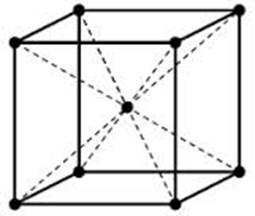
Рис. 1. Структуры решетки ГЦК и ОЦК
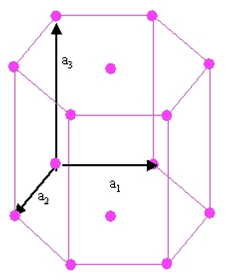
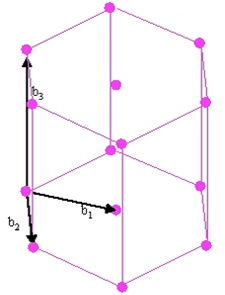
Рис. 2. Решетка ГЦК и соответствующая обратная решетка
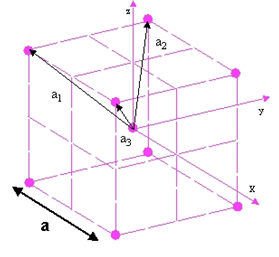
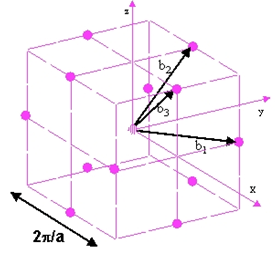
Рис. 3. Решетка ОЦК и соответствующая обратная решетка
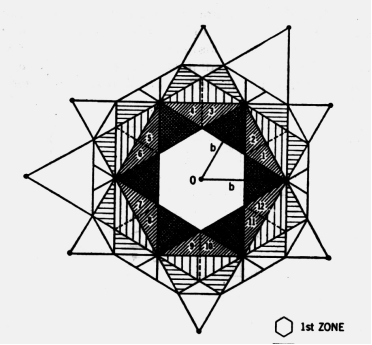
Рис. 4. Двумерная Зона Бриллюэна гексагональных решеток
Поверхность Ферми
Поверхность Ферми имеет сложную геометрическую форму, его схема поставляет на Рис. 5.
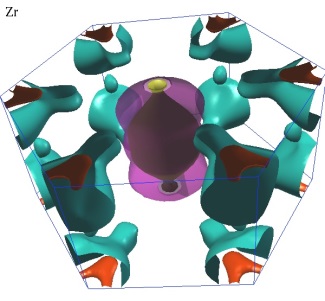
Рис. 5. Поверхность Ферми циркония [2]
Свойства циркония, как и других элементов, зависят от топологии поверхности Ферми.
Свойство микро и нано структур циркония
Физические свойства циркония в микроструктуре представлены в табл. 1.
Таблица 1 Свойства циркония в микроструктуре
|
Свойства |
Циркония |
|
Плотность |
6,506 г/см³ |
|
Температура плавления |
2125 K |
|
Температура кипения |
4650 K |
|
Теплота плавления |
19,2 кДж/моль |
|
Теплота испарения |
567 кДж/моль |
|
Молярная теплоёмкость |
25,3 Дж/(K·моль) |
|
Молярный объём |
14,1 см³/моль |
|
Температура Дебая |
291K |
|
Теплопроводность |
(300 K) 22,7 Вт/(м·К) |
|
Цвет |
Серебристо-серый |
О чистом нано цирконии информации нет, мы изучили диоксид циркония.
Свойства диоксида циркония [3]:
ZrO2 (диоксид циркония), бесцветные кристаллы, tпл= 2715 °C. Оксид циркония – один из наиболее тугоплавких оксидов металлов. Диоксид циркония проявляет амфотерные свойства, нерастворим в воде и водных растворах большинства кислот и щёлочей, однако растворяется в плавиковой и концентрирован-ной серной кислотах, расплавах щелочей. Сравнительные свойства циркония в микроструктуре и нано структуре показаны в табл. 2.
Таблица 2 Сравнительные свойства циркония в микроструктуре и нано структуре
|
Свойства |
Микроструктура (Zr) |
Наноструктура (ZrO2) |
|
Электропроводимость, См·м-1 |
43 |
2,43 |
|
Температура плавления, °С |
1852 |
2715 |
|
Плотность, г/см3 |
6,506 |
5,89 |
|
Длина свободного пробега, нм |
0,6 |
25 |
Физические причины изменения свойства в наноматериале [4, 5]
Из сравнения свойств циркония в микроструктуре и нано структуре, можно сказать, что некоторые свойства циркония изменились. Физические причины специфики заключаются в следующем:
1. Цирконий в нано материале обладает склонностью к самоорганизации кластерных структур;
2. Большая доля атомов находится на выступах и уступах поверхности. Поэтому свободная поверхность является стоком бесконечной емкости для точечных и линейных кристаллических дефектов;
3. Поверхностные эффекты механических свойств;
4. Тонкие физические эффекты взаимодействия электронов со свободной поверхностью.
Технологии получения
В промышленности исходным сырьем для производства циркония являются циркониевые концентраты с массовым содержанием диоксида циркония не менее 60-65 %, получаемые обогащением циркониевых руд.
Основные методы получения металлического циркония из концентратов — хлоридный, фторидный и щелочной процессы.
Хлоридный процесс основан на перевод циркония в летучий тетрахлорид ZrCl4 (Tсублимации 331 °C) с дальнейшей его очисткой и последующим металлотермическим восстановлением магнием в циркониевую губку. Используются два варианта хлорирования концентратов: прямое хлорирование смеси циркониевых концентратов с коксом хлорируют при 900—1000 °С и хлорирование предварительно полученных спеканием концентратов с коксом смеси карбидов и карбонитридов циркония при 400—900 °С:
ZrO2 + 2C + 2Cl2 → ZrCl4 + 2CO
ZrCl4 + 2Mg → Zr + 2MgCl2
При фторидном методе на первой стадии циркониевый концентрат спекают с гексафторсиликатом калия при 600—700 °С:
ZrO2 + K2 [SiF6] → K2 [ZrF6] + SiO2
Образовавшийся гексафторцирконат калия выщелачивают горячей водой и очищают фракционной перекристаллизацией от примеси гексафторгафната K2HfF6, после чего металлический цирконий получают электролизом расплава смеси гексафторцирконата калия и хлоридов калия и натрия [6].
Щелочной процесс является методом получения технически чистого диоксида циркония ZrO2, из которого металлический цирконий получают хлоридным или фторидным методом. В этом процессе цирконий переводится в растворимую форму спеканием концентрата с гидроксидом натрия при 600—650 °С, карбонатом натрия при 900—1100 °С либо со смесью карбоната и хлорида кальция при 1000—1300 °С, после чего образовавшиеся цирконаты натрия Na2ZrO3 или кальция CaZrO3 выщелачиваются соляной либо серной кислотами:
Na2ZrO3 + 4HCl → ZrOCl2 + 2NaCl + 2H2O
CaZrO3 + H2SO4 → ZrO(HSO4)2 + H2O
Водные растворы хлорида или сульфата цирконила далее очищаются и гидролизуются, осадок ZrO(OH)2 прокаливают и получают технический диоксид циркония ZrO2. [6]
Выводы и применение циркония и его сплавов
После исследования элемента циркония в микроструктуре и нано структуре и сравнения свойств, выяснились, что нано структуре имеет особенные свойства по сравнению с микроструктурой, например, электропроводимость диоксида циркония резко уменьшается, и его температура плавления намного повышается. Эти свойства обусловливают широкое применение циркония в промышленности.
Цирконий входит в состав ряда сплавов (на основе магния, титана, никеля, молибдена, ниобия и других металлов), используемых как конструкционные материалы.
Новые перспективы его применения в различных областях:
1. Атомная энергетика;
2. Черная металлургия;
3. Цветная металлургия;
4. Химические и нефтеперерабатывающие промышленности;
5. Электроника и электротехника;
6. Сплавы циркония применяют в качестве конструкционных материалов в ядерных реакторах;
7. Сплавы циркония используют в качестве коррозионно – стойкого материала в химическом машиностроении.

