Введение
Любое хирургическое лечение характеризуется развитием раневого процесса, течение и исход которого зависят от многих факторов: локализации раны, состояния общего и местного иммунитета, степени бактериальной загрязненности, лечебных мероприятий, а также характера и тяжести нанесенной травмы. Как правило, операционная рана в полости рта считается асептической, однако легко инфицируема в послеоперационный период вследствие наличия бактериальной микрофлоры полости рта [3]. Микробная контаминация подлежащих тканей при нарушении целостности слизистой оболочки, механическое влияние пищевого комка в зоне операции, а также отсутствие в достаточном количестве окружающих тканей способствуют тому, что заживление раневых поверхностей может происходить путем вторичного натяжения с формированием рубцовой ткани. Предотвращение развития рубцовых деформаций с сохранением архитектоники регенерируемых тканей после проведения хирургических вмешательств в полости рта, оптимизация сроков заживления является актуальной задачей. Научные исследования в данной области привели к появлению системы Endoret®-PRGF® (англ. Endogenous Regenerative Technology – Platelets rich in growth factors) – плазмы, обогащенной факторами роста.
Endoret®-PRGF® – это система, содержащая тромбоцитарные и плазменные белки, полученные из крови пациента. Ее активация хлоридом кальция позволяет получить матрицу фибрина, которая служит каркасом для расположения клеток, участвующих в заживлении раны, а также постепенно высвобождает пул белков и факторов роста. Рецепторы поврежденных клеток получают сигналы от факторов роста и приступают к пролиферации [7]. Задачей такой терапии является уменьшение воспалительных явлений, естественное восстановление формы и структуры регенерируемой ткани. Система содержит факторы роста, влияющие на формирование кровеносных сосудов и улучшение микроциркуляции, что позволяет доставлять питательные вещества и кислород в зону повреждения, оптимизируя процессы заживления [2].
Впервые методика Endoret®-PRGF® была разработана в Испании в 1995 г. Институтом Биотехнологии BTI, автором которой является доктор Eduardo Anitua. Изначально методика применялась в стоматологии, имплантологии и челюстно-лицевой хирургии, но в настоящее время широко используется и в других медицинских областях.
Универсальность технологии позволяет использовать ее в хирургической стоматологии в различных формах: в жидком состоянии, в виде сгустка, фибриновой мембраны. Так, например, жидкий Endoret®-PRGF® можно использовать для биоактивации поверхности дентальных имплантатов и ускорения заживления мягких тканей. Сгусток в сочетании с другими остеокондуктивными материалами обладает потенциалом, способствующим регенерации кости, а также может предотвращать рассеивание гранулированных заменителей кости. Фибриновая мембрана, как правило, используется в качестве барьерной мембраны при направленной костной регенерации.
Область применения Endoret®-PRGF® в стоматологии включает регенерацию альвеолы после удаления зуба, остеоинтеграцию дентальных имплантатов, восстановление костной ткани у пациентов, получающих лечение бисфосфонатами, синус-лифтинг, мукогингивальную хирургию, лечение остеоартрита височно-нижнечелюстного сустава.
1. Приготовление плазмы, богатой факторами роста
Для приготовления препарата производят забор периферической крови пациента объемом 10-20 мл. Кровь помещают в пробирки, которые содержат 3,8% раствор цитрата натрия в качестве антикоагулянта. Пробирки центрифугируют при 1800 об/мин в течение 8 мин при комнатной температуре. После центрифугирования кровь будет разделена на 3 фазы: эритроциты внизу, слой лейкоцитов (лейкоцитарная оболочка) и плазма сверху (см. Приложение 1 рис.1) [20]. Плазменный слой делится на две фракции: фракция 1 (F1) и фракция 2 (F2). F1 – это плазма с низким уровнем факторов роста. F2 PRGF – это 2 мл плазмы чуть выше лейкоцитарной пленки; та фракция, которая наиболее богата факторами роста – в 2-3 раза выше, чем в периферической крови. Каждая фракция активируется хлоридом кальция за несколько минут до использования (см. Приложение 1 рис.2) [23].
A-гранулы тромбоцитов содержат большое количество тромбоцитарных факторов роста (PDGFs): β-трансформирующий фактор роста (TGF-β, включая изомеры TGF-β1 и TGF-β2), сосудистый эндотелиальный фактор роста (VEGF), эпидермальный фактор роста (PD-EGF), инсулиноподобный фактор роста (IGF-1) и др. [5]. Тромбоциты действуют как носители биологически активных молекул, которые могут управлять судьбой клеток, таких как хондроциты, синовиоциты, макрофаги, мезенхимальные стволовые клетки, и, таким образом, влиять на анаболические процессы, уменьшать боль и улучшать функционирование тканей [7, 13].
2. Регенерация кости и мягких тканей после удаления зуба
Недостаточный объем и качество альвеолярной кости являются одним из главных ограничений для проведения дентальной имплантации. Потеря зуба приводит к атрофии костной ткани, которая может продолжаться вплоть до полной потери первоначального объема альвеолярной кости.
В настоящее время различают одномоментную имплантацию, выполняемую сразу после удаления зуба, и отсроченную на короткий, средней продолжительности и длительный срок, проводимую через 6-8 недель, 3-4 месяца и 9 месяцев соответственно [10].
Одномоментная имплантация предлагает пациенту множество функциональных и эстетических преимуществ в дополнение к значительному сокращению времени лечения. Тем не менее, такие ситуации, как наличие обширных периапикальных очагов, трехстенный дефект альвеолярной кости, рецессия десны могут стать противопоказанием к одномоментной имплантации. В таких случаях требуется длительное время заживления и регенерации альвеолы для обеспечения успеха имплантации.
С другой стороны, после удаления зуба костная ткань подвергается атрофии, а более длительное время ожидания увеличивает риск потери высоты и ширины кости альвеолярного гребня, что в некоторых случаях может затруднить постановку имплантатов. Именно в такой ситуации требуется разработать протоколы, которые позволят ускорить процесс регенерации и получить достаточный объем кератинизированной и костной ткани, идеальных для имплантации, а также сократить время ожидания для пациента [8].
Биотехнологическая альтернатива ускорению регенерации альвеолярной кости – введение в альвеолу препарата, богатого факторами роста. Endoret®-PRGF® является 100% аутологичным продуктом, который возможно относительно легко и экономично получить (4 флакона из 20 см3 крови) [5].
Лунка удаленного зуба заполняется сгустком, полученным путем активации в течение 6-7 минут Endoret®-PRGF® хлоридом кальция, и изолируется фибриновой мембраной, полученной путем 30-минутной активации плазмы, бедной факторами роста [6, 10].
В случаях обширного дефекта вестибулярной костной пластинки Endoret®-PRGF® можно использовать в сочетании с аутологичной костью. В проводимых за последние 5 лет исследованиях у более чем 2000 пациентов, которым проводилась та же процедура, никаких побочных эффектов не отмечалось. Напротив, заживление происходило быстрее, реже возникали боль и воспаление [8,10].
Регенерация мягких тканей при использовании Endoret®-PRGF® в качестве вспомогательного средства проходит быстрее и позволяет сформировать ровный десневой контур [13]. Дальнейшие исследования будут необходимы для сравнения эффективности этой процедуры с такими, как пересадка соединительнотканного трансплантата и пластика расщепленным лоскутом [10].
Что касается временного промежутка, при небольших дефектах через 8-10 недель, а при обширных дефектах через 14-16 недель может быть гарантировано оптимальное качество и плотность костной ткани [8,10].
Применение технологии Endoret®-PRGF® после удаления зуба уменьшает воспаление, боль, ускоряет заживление мягких тканей и способствует регенерации кости. Такая методика может быть использована после каждого удаления зуба вне зависимости от того, планируется ли в дальнейшем имплантация. Показатель выживаемости имплантата после удаления зуба и заполнения лунки плазмой, обогащенной факторами роста, составляет 98% [10].
Таким образом, использование технологии Endoret®-PRGF® позволяет получать достаточное количество и качество альвеолярной кости и кератинизированной десны после удаления зуба, сокращая время ожидания для пациента без какого-либо неблагоприятного эффекта [6, 8].
3. Остеоинтеграция дентальных имплантатов
Для создания биологически активной поверхности, которая будет способствовать остеоинтеграции имплантата, было предложено использовать жидкий Endoret®-PRGF® (см. Приложение 1 рис. 3). Улучшения остеогенных свойств можно добиться путем модификации поверхности внутрикостного имплантата и нанесения специфических белковых покрытий [1]. Кислотная обработка обеспечивает химически активные шероховатые поверхности, склонные вызывать тромботические реакции и превосходную остеоинтеграцию титана, а Endoret®-PRGF® в жидкой фазе коагулирует при контакте с титановым имплантатом, протравленным кислотой, и полученный фибриновый полимер прилипает к поверхности [11].
В исследованиях, сравнивающих остеоинтеграцию имплантатов, поверхность которых была обработана жидким Endoret®-PRGF®, и имплантатов, не подвергавшихся обработке (контрольная группа), было установлено, что применение обогащенной факторами роста плазмы увеличивает процент кости, контактирующей с имплантатом, на 84,7%. Гистологические срезы показали также некоторые интересные различия между обеими группами. Вся поверхность имплантатов, обработанных Endoret®-PRGF®, была покрыта новообразованной костью, тогда как в случае необработанных имплантатов только верхняя половина была окружена костной тканью (см. Приложение 1 рис. 4). Аналогичный результат был получен после удаления имплантатов. Обработанные Endoret®-PRGF® имплантаты оказались полностью окруженными твердым и плотным костным цилиндром, тогда как необработанные имплантаты были покрыты костью лишь частично [11].
Эти результаты могут быть частично объяснены митогенными, хемотаксическими и пролиферативными эффектами, вызванными, в первую очередь, факторами роста, стимулирующими пролиферацию клеток трабекулярной кости, стромальных стволовых клеток и мезенхимальных стволовых клеток человека. Кроме того, полярность титанового сплава способствует тому, что отрицательно заряженные белки, присутствующие в жидком Endoret®-PRGF®, адсорбируются на поверхности имплантата [11].
Использование обогащенной факторами роста плазмы является современным методом сокращения сроков остеинтеграции у пациентов с остеопорозом. Применение Endoret®-PRGF® на поверхности титанового имплантата может создать динамическую область с потенциальной биологической активностью, которая обеспечивает взаимодействие поверхности имплантата с окружающими тканями [18].
При остеопорозе наблюдаются изменения в кровеносных сосудах губчатого и компактного вещества челюстных костей, которые могут варьироваться от эндотелиальных повреждений до полной облитерации просвета сосуда. Происходит дегенерация коллагеновых волокон и, таким образом, костная ткань лишается органической основы для осаждения солей кальция. Учитывая эти проблемы, можно прийти к выводу, что методы, используемые для стимуляции процессов консолидации кости вокруг имплантата, должны в первую очередь стимулировать новообразование сосудов и синтез кости. С этой точки зрения Endoret®-PRGF® является подходящим материалом, поскольку содержит специфические факторы роста для этих процессов [18].
Таким образом, плазма, обогащенная факторами роста, помогает остеоинтегрировать имплантаты даже в костной ткани, пораженной остеопорозом, стимулируя относительно быстрое восстановление сосудистых и органических компонентов, и, наконец, минерализацию новообразованной кости и стабилизацию имплантата [18]. Местные клинические признаки (снижение интенсивности боли, незаметный отек) указывают на то, что Endoret®-PRGF® хорошо переносится организмом [13].
4. Лечение пациентов с бисфосфонатным остеонекрозом челюсти
Бисфосфонаты (БФ) представляют собой класс синтетических лекарств, обычно используемых для лечения метастазов в кости и различных заболеваний костей, которые вызывают их хрупкость (например, остеопороз). Связанный с бисфосфонатом остеонекроз челюсти является частым осложнением у пациентов, получавших БФ, особенно внутривенно [20].
Бисфосфонатный остеонекроз (БОН) челюсти представляет собой патологическое состояние, при котором имеется обнаженная некротическая кость в челюстно-лицевой области в течение 8 недель и более у пациента, который получал БФ и не подвергался ранее лучевой терапии. Существует также «неэкспонированный» вариант БОН, где некротическая кость не обнажена, но имеются рентгенологические признаки некроза челюстей, а также жалобы на боль, парестезию и отек [16].
Патогенез БОН до сих пор неясен, но считается, что ключевую роль играет ингибирование остеокластов (которое приводит к нарушению естественного процесса ремоделирования кости) и ингибирование ангиогенеза (которое замедляет заживление кости и мягких тканей) [16]. БОН обычно вызывается местной травмой, например, удалением зубов, другими зубочелюстными операциями и использованием зубных протезов. Также имеются данные о самопроизвольном возникновении, которое обычно вызывается одонтогенной и пародонтальной инфекцией. Более того, показано, что некоторые генетические мутации ассоциированы с БОН [20].
Одним из методов диагностики БОН является рентгенография (панорамные рентгенограммы, компьютерная томография). На рентгенограмме обычно выявляется чередование участков остеолизиса и остеосклероза, утолщение надкостницы, расширение периодонтальной щели, образование секвестров и рентгенологические признаки синусита. Там, где «неэкспонированная» некротическая кость не видна, дальнейшие исследования, такие как сцинтиграфия костей, позитронно-эмисионная томография, могут помочь в выявлении ранних очагов поражения кости [16].
В настоящее время разработаны различные методы лечения пациентов с БОН [17]. Один из них – использование антибиотиков, анальгетиков, противогрибковых препаратов, дезинфицирующих средств для полоскания полости рта. В краткосрочной перспективе консервативный подход имеет множество преимуществ для пациентов с не прогрессирующей стадией БОН, но нередко у таких больных возникают рецидивы и заболевание продолжает прогрессировать [13, 17].
Хирургический подход обусловлен тем, что обнаженная кость с ее острыми краями и образованием секвестров усиливает риск развития воспаления и должна быть удалена. Самым трудным решением является выбор количества кости, которую необходимо удалить. Резекция, как правило, проводится до тех пор, пока не будет получен запас «нормально кровоточащей» кости, поскольку кровотечение указывает на метаболический потенциал для заживления [9, 16].
Локальное хирургическое вмешательство подразумевает удаление только свободных секвестров, но не всей некротической зоны, с минимальным повреждением вышележащих мягких тканей и низким риском перелома кости [9, 16].
При радикальном лечении выполняются «маргинальные резекции» (резекция альвеолярной части без потери непрерывности нижней челюсти) и «сегментарные резекции» (непрерывность нижней челюсти нарушается и восстанавливается с помощью костных аутотрансплантатов) [17].
Хорошие результаты лечения БОН показывает резекция некротической кости с последующим заполнением дефекта Endoret®-PRGF®. Использование Endoret®-PRGF® увеличивает количество множества факторов роста [16, 17, 19]. Так, выделение VEGF – фактора роста эндотелия сосудов – опережает один из основных факторов патогенеза остеонекроза – отсутствие васкуляризации. Выделение TGF-β, фактора роста, участвующего в пролиферации и дифференцировки остеобластов, продукции внеклеточного матрикса, и BMP-7, фактора роста, участвующего в остеогенезе, способствуют заживлению костной и мягких тканей. Таким образом достигается ремоделирование кости, а также заживление и закрытие изъязвленного дефекта слизистой оболочки полости рта [9, 20].
Через 4 недели после операции на дне дефекта образуется ткань, которая практически эпителизирована; костная ткань не обнажена в полость рта. На КЛКТ определяется отсутствие некротической кости и формирование кортикальной пластинки [9].
5. Синус-лифтинг
Синус-лифтинг является хирургической операцией, проводимой с целью увеличения объема кости в боковом отделе на верхней челюсти для последующей установки имплантата и протезирования. Использование имплантатов достаточной длины может потребовать поднятия слизистой оболочки, выстилающей полость верхнечелюстного синуса, и субантрального размещения костного трансплантата. Показанием для проведения операции является высота альвеолярного отростка в области отсутствующих зубов менее 8 мм, при высоте более 4 мм возможна одномоментная имплантация [21].
Существует большое разнообразие материалов, используемых в качестве костных трансплантатов. На сегодняшний день «золотым стандартом» остается аутологичная кость, поскольку она обеспечивает остеогенность, остеоиндукцию и остеокондукцию, содержит жизнеспособные костные клетки, не обладает антигенными свойствами. Тем не менее, получение аутологичных трансплантатов требует формирования дополнительных донорских участков, более длительного времени для восстановления, необходимости анестезиологического сопровождения. Забор костного материала из интраоральных участков характеризуется ограничением доступности донорских участков, увеличением времени процедуры, повышенным дискомфортом для пациента в послеоперационном периоде, ограниченным количеством доступной кости.
Для проведения синус-лифтинга с последующей установкой дентальных имплантатов было предложено использовать комбинацию костно-пластических материалов и плазмы, обогащенной факторами роста [21, 25].
Перфорация мембраны Шнайдера является наиболее распространенным осложнением при выполнении открытого синус-лифтинга со средней зарегистрированной частотой 19,5% [25]. Перфорация может вызвать развитие хронического синусита, попадание остеопластического материала из субантральной полости в полость пазухи [22].
Для снижения риска возникновения интраоперационных и послеоперационных осложнений может быть эффективным использование плазмы, обогащенной факторами роста. После первоначального отделения синусовой мембраны от дна верхнечелюстной пазухи Endoret®-PRGF® располагают над поверхностью мембраны так, чтоб «крыша» вновь созданной костной полости состояла из сгустка Endoret®-PRGF®. Сгусток остается прочно прикрепленным к поднятой мембране. Для заполнения полости можно использовать депротеинизированный бычий костный матрикс, объединив с жидкой фракцией Endoret®-PRGF®. Для защиты окна, созданного в стенке пазухи, устанавливают фибриновую мембрану Endoret®-PRGF®. После репозиции слизисто-надкостничного лоскута в рану через иглу вводят жидкий Endoret®-PRGF® для ускорения заживления (см. Приложение 1 рис. 5-12) [25].
Эластичность сгустка, а также его плотная адгезия к синусовой мембране могут обеспечить более безопасное и более атравматичное управление самой мембраной во время фазы отслоения, а также предотвращает возникновение разрывов мембраны и ее перфорацию. Из-за гидравлического давления, вызванного самим сгустком, уменьшаются силы, способствующие его отрыву [21]. После завершения процедуры подъема дна пазухи сгусток Endoret®-PRGF® остается прикрепленным к синусовой мембране, дополнительно защищая саму мембрану по время заполнения полости. Использование жидкого Endoret®-PRGF® для смешивания с гранулированным заменителем кости и получение гелеобразной консистенции предотвращает попадание гранул в пазуху при случайной перфорации мембраны. Наконец, гемостатические свойства Endoret®-PRGF® обеспечивают отсутствие носовых кровотечений в случае отрыва мембраны от мезиальной стенки и повреждения задних боковых носовых артерий [25].
При взаимодействии Endoret®-PRGF® с мягкими твердыми тканями высвобождается ряд факторов, участвующих в регенерации тканей, таких как фибриноген, фибронектин, фактор роста эндотелия сосудов, трансформирующий фактор роста бета [5, 7]. Концентрат обладает выраженным противовоспалительным действием за счет подавления провоспалительных хемокинов, таких как IL-143,44, а также обладает противомикробным эффектом [7]. Эти характеристики, наряду с гемостатическими свойствами и высокой биосовместимостью, способствуют снижению послеоперационного дискомфорта, что благоприятно влияет на качество жизни пациентов [21].
6. Лечение заболеваний пародонта
Одним из признаков прогрессирования заболеваний пародонта является формирование внутрикостных дефектов. Для восстановления поврежденных структур было предложено использовать плазму, обогащенную факторами роста. Этот 100% аутологичный препарат обогащен биологическими медиаторами, которые ускоряют регенерацию как твердых, так и мягких тканей [14].
Исследования in vitro показывают, что Endoret®-PRGF® инициирует пролиферацию фибробластов и способствует заживлению ран эпителиальной ткани, может стимулировать пролиферацию, миграцию и хемотаксис остеобластов и значительно усиливать аутокринную экспрессию двух проангиогенных факторов: фактор роста эндотелия сосудов (VEGF) и фактор роста гепатоцитов (HGF), а также трех маркеров активности остеобластов (проколлаген I, остеокальцин, щелочная фосфатаза). Следовательно, факторы роста, происходящие из тромбоцитов, поддерживают регенерацию кости, главным образом, посредством хемотаксического и митогенного воздействия на преостеобластные и остеобластические клетки [13].
Инъекция аутологичной плазмы в область зубодесневых сосочков и маргинальной десны в комплексной терапии хронического катарального гингивита улучшает клиническую картину, стабилизирует воспалительный процесс и снижает частоту рецидивов. Отмечается пролонгированный эффект, характеризующийся снижением в течение трех месяцев показателей индексов OHI-S, PMA (в модификации Parma C.), индекса кровоточивости (ИК), которые в течение года оставались на том же уровне (см. Приложение 1 рис. 13-14). В контрольной же группе отмечалось ухудшение показателей индексов спустя 3 месяца [4].
С другой стороны, клинические испытания показывают, что при применении PRGF не удается значительно восстановить пародонтальные внутрикостные дефекты и уровень прикрепления десны. Было отмечено восстановление костной ткани при наличии фуркационных дефектов II класса с помощью аутогенных костных трансплантатов, с или без Endoret®-PRGF® [14]. Наблюдается несколько лучший результат направленной тканевой регенерации в сочетании с Endoret®-PRGF®, но он не достиг статистически значимого уровня и требует дальнейших исследований. Также отсутствуют данные, подтверждающие влияние Endoret®-PRGF® на послеоперационные симптомы, такие как боль и отек [23].
Исследования, изучающие закрытие поверхности обнаженного корня при рецессиях I-II класса по Миллеру, показывают, что глубина рецессии становится чуть меньше при использовании субэпителиального соединительнотканного трансплантата (ССТ) и Endoret®-PRGF®, чем один ССТ. Однако эти различия не являются статистически значимыми и требуют проведения исследований с большим количеством случаев и более длительными периодами наблюдения в сочетании с гистологическими исследованиями [15].
7. Лечение заболеваний височно-нижнечелюстного сустава
Дисфункция височно-нижнечелюстного сустава (ВНЧС), как правило, характеризуется появлением щелкающего звука и болью в суставе. Хотя заболевание имеет мультифакторный генез, основной причиной считается неправильное положение нижней челюсти по отношению к черепу. Такие анатомические условия, как нарушение прикуса или потеря боковой группы зубов, представляют собой элементы, которые изменяют пространственное положение нижней челюсти относительно черепа, и, следовательно, мыщелкового отростка по отношению к мениску и суставной полости, вызывая дисфункцию ВНЧС. Со временем это дисфункциональное состояние будет вызывать прогрессирующую дегенерацию суставных структур (артроз) с утяжелением симптоматики во время движений нижней челюсти, хотя боль может появляться даже во время отдыха [13].
Методом выбора в случаях артропатии является суставная инъекция гиалуроновой кислоты (ГК) или кортикостероидов (КС), что позволяет устранить боль и улучшить функцию сустава. Однако длительное применение КС снижает их эффективность и оказывает побочные эффекты на метаболизм кости [24].
Другой безопасный и эффективный метод лечения заключается в инъекции плазмы, богатой факторами роста (см. Приложение 1 рис. 15) [5]. Известно, что факторы роста, содержащиеся в концентратах тромбоцитов, влияют на анаболические и катаболические процессы, участвуют в дифференцировке хондроцитов и в регенерации суставного хряща [12].
Клинические исследования показали, что улучшение симптоматики происходит после двух инъекций с диапазоном 30 дней в периартикулярное пространство, верхнюю суставную щель и биламинарную зону без одновременного использования фармакологических препаратов. Объем введенной плазмы составляет 1,5-2 мл как в периартикулярное пространство, так и во внутрисуставную область. После первой инъекции у всех пациентов отмечается полная или частичная ремиссия болезненной симптоматики уже через 7 дней. После второй инъекции полностью исчезает боль, открывание рта увеличивается в среднем на 12 мм, а через 6 месяцев состояние становится стабильным. Контроль в течение 1 года подтвердил эффективность данного вида лечения, отмечается отсутствие рецидива боли или других проблем ВНЧС [12]. Эти результаты, вероятно, обусловлены высвобождением, как во внутрисуставных, так и околосуставных областях факторов роста. Эффект состоит в быстром неонангиогенезе, который необходим для восстановления поврежденных тканей, в дополнение к хемотаксису макрофагов и фибробластов, пролиферации хондробластов, которые способствуют заживлению поврежденных тканей. По этой причине инъекция Endoret®-PRGF® является эффективным способом лечения остеоартрита ВНЧС [13].
Тем не менее, инъекция Endoret®-PRGF® не приводит к значительному улучшению клинического состояния спустя 2 года у пациентов с внутренними нарушениями ВНЧС IV стадии по классификации Уилкса [24].
По сравнению с гиалуроновой кислотой, инъекции обогащенной факторами роста плазмы показали более высокую и более длительную эффективность в снижении боли и восстановлении функции сустава [12].
Таким образом, технология Endoret®-PRGF® представляет собой эффективный метод устранения боли и улучшения функционального состояния ВНЧС, поскольку результатом лечения является значительное увеличение степени открывания рта и устранение болевой симптоматики [12]. Кроме того, метод позволяет быстро получить результат и прост в применении. Однако значительного улучшения клинических результатов через 2 года после операции у пациентов с выраженной патологией ВНЧС не происходит [24].
Заключение
Основными целями современной хирургии являются бережное отношение к тканям, малая инвазивность и высокая эффективность операции. Endoret®-PRGF® высвобождает факторы роста, а также биологически активные белки, концентрация которых в участках введения выше, чем их концентрация в крови. Более того, аутологичная плазма изготавливается из собственной крови пациента, что сводит на нет риск развития аллергических реакций. Технология Endoret®-PRGF® стала популярной в различных областях стоматологии (эндодонтия, имплантология, хирургическая стоматология и пародонтология) за последнее десятилетие.
Представленный обзор литературы об использовании технологии Endoret®-PRGF® в различных областях стоматологии показывает положительные результаты применения. Данные, накопленные как в доклинических, так и в клинических условиях, свидетельствует о том, что богатые факторами роста препараты плазмы имеют существенные преимущества.
Приложение 1. Использование богатой факторами роста плазмы в стоматологии.
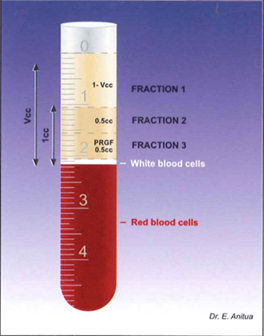
Рис. 1. Фракции, полученные после центрифугирования [10].
Рис. 2. Активатором Endoret®-PRGF® является хлорид кальция, который вызывает коагуляцию фракций плазмы [10].
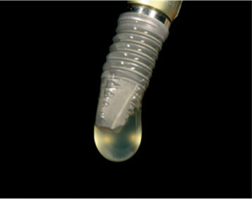
Рис. 3. Макроскопический рисунок дентального имплантата, поверхность которого обработана жидким Endoret®-PRGF®.
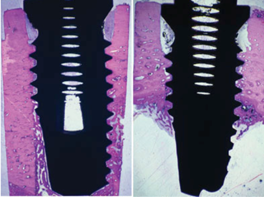
Рис. 4. Гистологические срезы имплантата, обработанного (слева) и необработанного (справа) Endoret®-PRGF®, спустя 8 недель после установки.
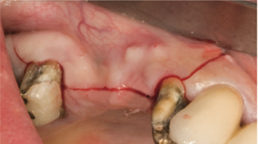
Рис. 5. Трапециевидный разрез [25].
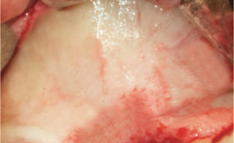
Рис. 6. Отслоение слизисто-надкостничного лоскута [25].
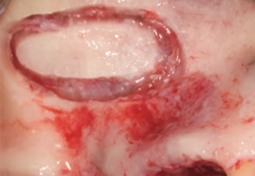
Рис. 7. Формирование костного окна овальной формы [25].
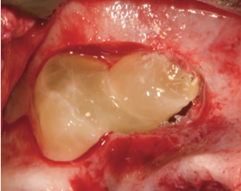
Рис. 8. Endoret®-PRGF® располагают над поверхностью мембраны так, чтоб крыша вновь созданной костной полости состояла из сгустка [25].
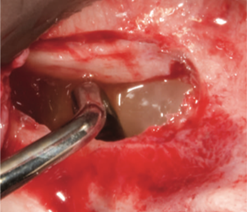
Рис. 9. Поднятие синусовой мембраны [25].
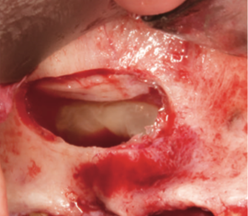
Рис. 10. После поднятия дна верхнечелюстной пазухи сгусток остается прочно прикрепленным к поднятой мембране [25].
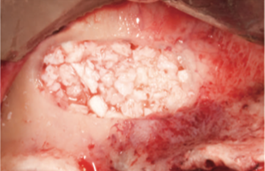
Рис. 11. Полость заполнена депротеинизированной бычьей костной матрицей, смешанной с жидким Endoret®-PRGF® [25].
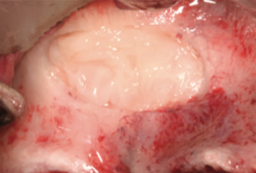
Рис. 12. После заполнения полости была установлена мембрана Endoret®-PRGF® для защиты окна, созданного в стенке пазухи [25].
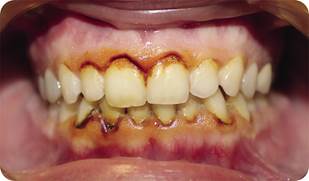
Рис. 11. Пациентка до лечения. Проба Шиллера-Писарева положительная [10].
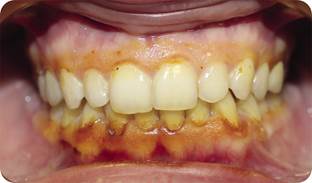
Рис. 12. Пациентка через 1 месяц после лечения. Проба Шиллера-Писарева слабоположительная [10].
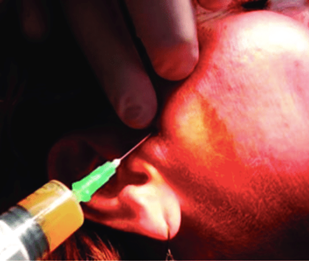
Рис. 13. Внутрисуставная инъекция ВНЧС с использованием Endoret®-PRGF® [12].
Библиографическая ссылка
Дубчак М.А. ПРИМЕНЕНИЕ ПЛАЗМЫ, ОБОГАЩЕННОЙ ФАКТОРАМИ РОСТА, В ХИРУРГИЧЕСКОЙ СТОМАТОЛОГИИ // Международный студенческий научный вестник. 2019. № 5-2. ;URL: https://eduherald.ru/ru/article/view?id=19815 (дата обращения: 06.04.2025).

