Введение. В медицинской практике во время терапии, используют инвазивные методы лечения. Одним из таких методов является введение в кровяное русло препаратов , в том числе введение многокомпонентных физиологических растворов, для нормализации электролитного баланса и восполнения питательных веществ.[7]
Любой препарат и инфузионный раствор обладает своими химико-физическими свойствами и строго определенным химическим составом, способным вызывать осмотические явления и вызывать морфологические изменения клеток. Следовательно, введение препаратов и инфузионных растворов в организм человека может нарушать изменения строения форменных элементов крови, что приводит к нарушению их функций и, как следствие, отражается на здоровье пациента. [3][7][8]
Безопасность лекарственных средств доказана на практике, при их применении в строго определенных концентрациях. Однако в медицине практикуется введение инфузионных растворов в разной концентрации, а так же иногда препараты вводятся без их разведения, например при оказании скорой медицинской помощи. Введение инфузионных растворов в разной концентрации, а так же, в особенности, введение препаратов без разведения может иметь непредсказуемые последствия, как для кровеносной системы, так и для организма.[1][3][7]
Следовательно, существует необходимость проверить, как реагируют компоненты крови на введение препаратов и инфузионных растворов в повышенной концентрации.
Поскольку эритроциты являются многочисленными форменными элементами крови и легко визуализируются при микроскопии, то изучая воздействие различных препаратов и растворов на них, мы получим наиболее достоверные результаты.
Цель работы: выяснить, происходят ли изменения эритроцитов при их взаимодействии с некоторыми лекарственными средствами.
Материалы и методы: В качестве основного материала для исследования была использована кровь человека. Для проведения опытов нами были выбраны 500 добровольцев одного пола и примерно одного возраста. Характеристика доноров: мужчины от 20 до 25 лет, имеющие разные группы крови по системе AB0: I(+), II(+), III(+). Заболеваний системы крови на момент забора биологического материала доноры не имели, хронические заболевания отрицали. Забор венозной крови производился натощак.
Для исследования нами были выбраны наиболее часто используемые в медицинской практике препараты и растворы. Препараты: 5% медицинский спирт, 4% калий хлорид, 25% магний сульфат. Инфузионные растворы: 40% раствор глюкозы, 4.20% раствор соды-буфер.
Используемые методы: забор биологического материала (внутривенная пункция), фиксация биологического материала in vitro, световая микроскопия при увеличении в 1600крат, фотографирование, морфометрия.
Результаты и обсуждение. Морфологические параметры объекта исследования до и после проведения опыта in vitro были занесены в протокол исследования, который представляет таблица №1.
Таблица№1
Морфологические параметры объекта исследования (погрешность измерений составила ± 1 мкм)
|
Опыт |
Размеры эритроцитов |
Примечание |
|||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
средний |
|||
|
Контроль |
б/г |
7,2 |
7,5 |
7,6 |
7,7 |
6,8 |
7,5 |
7,5 |
7,5 |
7,4 |
7,6 |
7,43 |
N* |
|
Контроль |
0 |
7,8 |
7,6 |
7,5 |
7,8 |
7,7 |
7,6 |
7,5 |
7,3 |
7,6 |
7,8 |
7,62 |
N |
|
3 |
7,5 |
7,6 |
7,8 |
7,9 |
7,4 |
7,4 |
7,6 |
7,3 |
7,7 |
7,8 |
7,6 |
N |
|
|
7 |
7,5 |
7,4 |
7,3 |
7,5 |
7,6 |
7,4 |
7,6 |
7,6 |
7,4 |
7,5 |
7,48 |
N |
|
|
13 |
7,3 |
7,2 |
7,3 |
7,4 |
6,8 |
6,8 |
7,2 |
6,8 |
6,7 |
7,8 |
7,13 |
Частична DO** |
|
|
20 |
14,4 |
12,6 |
12,8 |
14,0 |
11,7 |
13,2 |
12,5 |
13,3 |
11,9 |
12,8 |
12,92 |
DPM |
|
|
Сода-буфер |
1 |
Не удалось получить достоверных результатов, из-за DC,TG. |
S,DO,DC |
||||||||||
|
2 |
14,4 |
15,0 |
14,1 |
13,5 |
15,2 |
14,3 |
13,6 |
13,9 |
14,3 |
11,5 |
13,98 |
||
|
3 |
Не удалось получить достоверных результатов, из-за DC |
S,DC |
|||||||||||
|
Этиловый спирт |
1 |
Не удалось получить достоверных результатов, из-за полного разрушения клеток, или изменения их формы |
DC |
||||||||||
|
2 |
Изменения формы |
||||||||||||
|
3 |
100% DC |
||||||||||||
|
Калия хлорид |
1 |
10,8 |
11,0 |
9,8 |
10,5 |
11,2 |
9,5 |
10,2 |
Не дост., рез. |
10,4 |
DPM,DC |
||
|
2 |
9,8 |
10,0 |
12,0 |
11,5 |
12,5 |
12,8 |
11,5 |
7,5 |
10,2 |
9,5 |
10,73 |
Нет деформаций |
|
|
3 |
11,0 |
12,5 |
11,0 |
10,2 |
12,5 |
9,5 |
11,2 |
8,8 |
10,5 |
11,3 |
10,85 |
Нет деформаций |
|
|
Магния сульфат |
1 |
16,3 |
13,5 |
15,4 |
16,1 |
14,5 |
15,2 |
16,3 |
14,8 |
15,0 |
15,2 |
15,23 |
DO,S |
|
2 |
12.5 |
13.5 |
12.8 |
11.5 |
12.0 |
14.8 |
12.5 |
16.1 |
12.5 |
11.3 |
12,95 |
DO,S |
|
|
3 |
15,0 |
14,5 |
13,0 |
15,0 |
16,0 |
12,6 |
13,0 |
10,0 |
- |
- |
13,76 |
DC,S |
|
|
Глюкоза |
1 |
Не удалось получить достоверных результатов, из-за сильного слипания и как следствия изменения форм клеток. |
DO,DC,S |
||||||||||
|
2 |
|||||||||||||
|
3 |
|||||||||||||
Примечание: N – нормально, нормальный, DPM – деформация плазматической мембраны ,DО – деформация оболочки, LD − линейный размер, S – сладж феномен, DC – деформация клетки (частично, полностью).
Анализ исследования: результаты контроля показывают, что образец, нанесенный на стекло без гепарина и образец нанесенный на стекло с гепарином не имеют отличий (кроме времени необходимого для начала процессов коагуляции крови), морфологические показатели сохраняются в норме, следовательно, использование гепарина, как искусственного антикоагулятора, для увеличения длительности работы с биологическим материалом, не влечет за собой последствий, которые могут значительно повлиять на результаты опытов.
Образцы, взятые у разных доноров практически идентичны по морфологическим показателям − размеры и нормальная форма соответствуют стандартным.
Так же нами определено придельное время работы с биологическим материалом, которое рассчитывалось исходя из контрольных экспериментов, и составляло 7 минут!
Таким образом, исходя из контрольных опытов, можно выделить следующие особенности проведения исследования:
· длительность экспозиции, не превышающая 7 минут;
· оправданное использование гепарина, не оказывающего влияние на морфологию эритроцитов;
· отсутствие учёта индивидуальной специфики эритроцитов каждого донора, так как контрольные результаты всех доноров сходны по морфологическим показателям.
Анализ переменных опытов: Первый опыт с содой-буфер(4.20%).
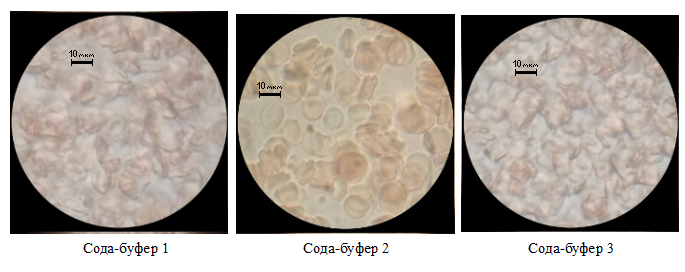
Рисунок 1. Примеры изменения морфологических свойств эритроцитов. Сода-буфер 4.20%.
При воздействии сода-буфера в двух образцах наблюдается очень сильная деформация формы клеток и визуальное соединение, что делает невозможным определение линейных размеров. При этом значительно увеличиваются диаметры эритроцитов, примерно в два раза. Причиной является избыток натрия во внешней среде, который приводит к снижению потенциала покоя клетки, открытию ионных каналов мембран и активному транспорту жидкости внутрь клетки.[1][2][3][5][6]
Второй опыт с 5% медицинским (этиловым) спиртом.

Рисунок 2. Примеры изменения морфологических свойств эритроцитов. Этиловый спирт- 5%.
При воздействии 5% раствора спирта наблюдается значительная деформация клеточных мембран, происходит их частичный разрыв и разрушение оболочек эритроцитов, приводящий к глобальным морфологическим изменениям: полной потери формы и структуры. Линейные размеры клеток невозможно определить, что связано с частичным выходом цитоплазмы в окружающую среду из-за разрушения спиртом липидного слоя мембраны. [1][2][3][5]
Третий опыт с калия хлорид- 4%.
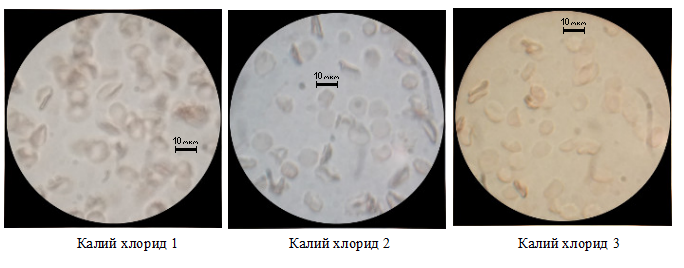
Рисунок 3. Примеры изменения морфологических свойств эритроцитов. Калий хлорид-4%
При воздействии калия хлорида эритроциты, лежащие под правильным углом, видимых деформационных изменений не имеют, но наблюдается увеличение размеров в пределах 30%, что является следствием прекращения естественного транспорта калия из клетки из-за избытка катионов калия во внешней среде и прекращения оттока жидкости. Одновременно с этим идёт активное проникновение анионов хлора внутрь клетки, т.к. там высокая концентрация натрия имеющего положительный заряд (движение по электрическому градиенту). Это приводит к повышению концентрации ионов внутри клетки и движению воды внутрь по градиенту концентрации. Объем цитоплазмы незначительно увеличивается. [1][2][3][5]
Четвертый опыт с магний сульфат-20%.
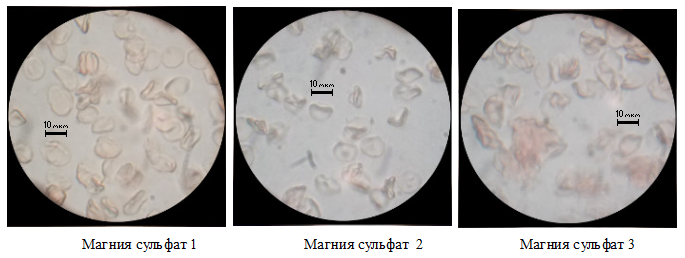
Рисунок 4. Примеры изменения морфологических свойств эритроцитов. Магния сульфат-20%.
При воздействии магния сульфата эритроциты увеличиваются неравномерно. Морфологические деформации незначительные, наблюдается вытягивание и уплощение клеток с потерей дисковидной формы. Это связано с нарушением нормального транспорта веществ через мембрану, т.к. магний входит в состав фермента участвующего в переносе калия, натрия и кальция через активный ионный канал. Как следствие идет как ускорение, так и замедление процессов транспорта жидкости внутрь клетки и возникновение деформаций. [1][2][3][5]
Пятый опыт с глюкозой-40%.
40% раствор глюкозы спровоцировал сильные морфологические изменения, что сделало невозможным определение линейных размеров. Такие изменения вызваны высокой концентрацией вещества, не способного проникнуть самостоятельно через мембрану. Вода из цитоплазмы начинает движение по градиенту концентрации из клетки в окружающую среду. клетки неравномерно сжимаются и деформируются теряя дисковидную форму. Визуально повреждённые эритроциты кажутся крупнее из-за процессов слипания, которые провоцируются гипертоническим раствором глюкозы. [1][2][3][5][8]
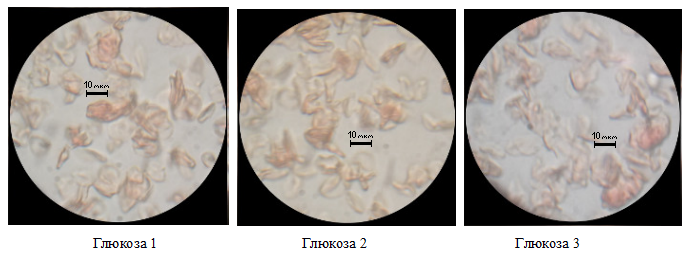
Рисунок 5. Примеры изменения морфологических свойств эритроцитов. Глюкоза-40%.
Заключение. На основании результатов проведённого исследования можно сделать выводы, что все препараты, взятые нами в качестве тестовых, провоцируют морфологические изменения эритроцитов. Объем и качество этих изменений зависят от типа веществ.
Наибольшие дефекты формы эритроцитов возникают при воздействии глюкозы, раствора сода-буфер, полное разрушение − при воздействии спирта, изменения линейных размеров провоцируется воздействием всех тестируемых веществ, процесс слипания наблюдается в ходе воздействия раствора глюкозы.
Таким образом, при введении некоторых медикаментозных препаратов и инфузионных растворов необходимо учитывать специфику их воздействия на элементы крови, чтобы не спровоцировать необратимых морфологических изменений в эритроцитах, которые повлияют на функционирование кровеносной системы и как следствие – организма.
Библиографическая ссылка
Никитин Е.А. МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ ЭРИТРОЦИТОВ ПОД ВЛИЯНИЕМ ЛЕКАРСТВЕННЫХ СРЕДСТВ // Международный студенческий научный вестник. 2017. № 3. ;URL: https://eduherald.ru/ru/article/view?id=17218 (дата обращения: 06.04.2025).

