Гипоксия – типовой патологический процесс, характеризующийся уменьшением рО2 в тканях (ниже 20 мм рт. ст.) и абсолютной или относительной недостаточности биологического окисления в клетке. Гипоксия приводит к расстройству функций органов и тканей, нарушению пластических и энергетических процессов в организме, морфологическим изменениям клеток. По этиологии выделяют несколько типов гипоксии, условно объединяемых в две группы: экзогенные и эндогенные. Гемическая (кровяная) гипоксия относится к эндогенной гипоксии, возникает при уменьшении кислородной емкости крови из-за снижения содержания гемоглобина (Нb) в единице объема крови и нарушения транспортных свойств Нb. Гемический тип гипоксии характеризуется снижением способности Нb эритроцитов связывать кислород (в капиллярах легких), транспортировать и отдавать оптимальное количество его в тканях. Уменьшение содержания Нb в единице объема крови и в организме в целом наблюдается при существенном уменьшении числа эритроцитов и/или снижении содержания Нb (иногда до 40-60г/л), т.е. при выраженных анемиях. Нарушение транспортных свойств Нb обусловлены изменением его способности к оксигенации в крови капилляров альвеол и дезоксигенации в капиллярах тканей. Эти изменения (гемоглобинопатии) могут быть наследуемыми или приобретенными. Наследуемые гемоглобинопатии чаще всего возникают из-за мутации генов, сопровождающихся нарушением аминокислотного состава глобинов. Причиной приобретенных гемоглобинопатий чаще всего является повышенное содержание в крови метгемоглобинообразователей, окиси углерода, нитроксигемоглобина. При гемической гипоксии происходит изменения газового состава и рН крови /1/.
В настоящее время резко возрос интерес исследователей к выявлению влияния лекарственных веществ на структурно-функциональные свойства белков в организме. Детальное исследование взаимодействия лекарства с белками-ферментами и их надмолекулярными комплексами имеет важное значение для выявления механизмов их лекарственного и побочного действия на биосистемы. Галоперидол – антипсихотический препарат, применяемый при шизофрении, бредовых расстройствах и других заболеваниях, сопровождающихся галлюцинациями, психомоторным возбуждением /2/. Легкость проникновения лекарства через мембрану определяется липофильностью галоперидола. Так как один из этапов пребывания галоперидола в организме связан с поступлением его в кровь и связыванием с ее белками и форменными элементами, целесообразным представляется изучение влияния данного нейролептика на функционирование гемоглобина. Поскольку гемоглобин локализован в эритроцитах, нами были изучены кислородтранспортные свойства гемоглобина, модифицированного галоперидолом, в составе эритроцитарных клеток.
В опытах использовали термостатированные при 37оС суспензии эритроцитов в Na-P буфере концентрацией 0,01 моль/л (рН 7,4), приготовленные на растворе хлорида натрия концентрацией 0,145 моль/л и растворы галоперидола в Na-P буфере (рН 7,4) с концентрациями модификатора 1×10-6, 1×10-5, 1×10-4 моль/л соответственно). Регистрацию кривых диссоциации оксигемоглобина (КДО) в составе эритроцитов осуществляли спектрофотометрическим методом, при 430 Нм (полоса Соре дезоксиформы). В качестве образца сравнения использовали светорассеивающую пластину, что позволило исключить вклад рассеяния света суспензией.
КДО показывает зависимость насыщения гемоглобина О2 от парциального напряжения О2. Важными показателями, характеризующими процесс обратимого связывания кислорода гемоглобином, являются значения Р50, т.е. парциальное давление кислорода, при котором гемоглобин насыщен им на 50% и константа Хилла (α), отражающая степень гем-гемового взаимодействия субъединиц в олигомере /3/. Анализ данных, представленных на рис. 1 показывает, что добавление галоперидола в указанных концентрациях повышает сродство гембелка к кислороду, при этом модифицирующее действие нейролептика носит выраженную концентрационную зависимость. Минимальная из использованных концентраций галоперидола индуцирует снижение значения Р50 с 22,8±1,04 до 17,5±0,51 мм рт. столба. Последующее увеличение концентрации до 1×10-5 и 1×10-4 моль/л приводит к дальнейшему повышению сродства гембелка к кислороду (Р50 составляет 13,1±1,3 и 12,6±2,5 мм рт. столба). Модификация внутриэритроцитарного гемоглобина галоперидолом находит отражение и в уровне кооперативного взаимодействия субъединиц в составе тетрамера. Зависимость значения константы Хилла от концентрации нейролептика носит сложный характер (рис.1). При использовании галоперидола в концентрации 1×10-6 моль/л величина α снижается с 2,92±0,21 (контроль) до 2,18±0,02. Последующее увеличение концентрации модификатора до 1×10-5 моль/л не вызывает статистически достоверных изменений α, которое составляет 2,26±0,17. В случае использования максимальной из использованных концентраций галоперидола наблюдается существенное снижение константы Хилла α до 1,85±0,12. Понижение величины α свидетельствует об ослаблении кооперативного эффекта.
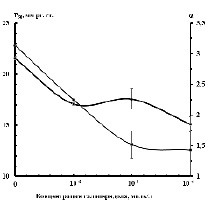
Рис. 1. Изменение значений Р50 и α при действие галоперидола
Полученные данные показывают, что галоперидол проникает через эритроцитарную мембрану и оказывает непосредственное воздействие на внутриэритроцитарный гемоглобин, что находит отражение в изменении основных макрохарактеристик его кислородсвязывающей способности. При этом выявленные нарушения функциональной активности гембелка при действии галоперидола обусловлены, по-видимому, конформационными перестройками апобелковой части молекулы, затрагивающей вероятно, области субъединичных контактов. Характер изменений величины Р50 и α позволяет предположить, что при использовании высоких концентраций галоперидола преимущественную роль приобретают перестройки третичной структуры гембелка.
В заключение можно сделать вывод, что наблюдаемый сдвиг КДО влево при воздействии лекарственного препарата свидетельствует о повышении сродства гемоглобина к кислороду и затруднению отдачи кислорода тканям.
Библиографическая ссылка
Фурсова У.Н., Лущик М.В. ГЕМИЧЕСКАЯ ГИПОКСИЯ И ИЗМЕНЕНИЕ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ГЕМОГЛОБИНА // Международный студенческий научный вестник. 2015. № 2-1. ;URL: https://eduherald.ru/ru/article/view?id=12221 (дата обращения: 07.04.2025).

