Впервые в 1958 г. Арон Лернер из Йельского университета (США) выделил из эпифиза быка, изучил и описал структуру мелатонина (N-ацетил-5-метокситриптамин) (рис.1). Эта биологически важная молекула впоследствии была найдена в сетчатке глаза, клетках костного мозга, кишечника и кожи. Изначально мелатонин считался гормоном, участвующим в синхронизации механизмов циркадного ритма в организме.
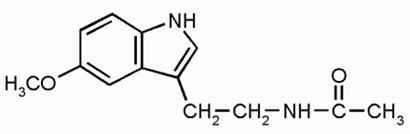
Рис.1 Структурная формула мелатонина
Позже было установлено, что кроме этой гормональной функции он принимает участие в регуляции сезонного и лунного циклов у животных и человека. Кроме того, он является тканевым фактором и одним из самых мощных и доступных эндогенных антиоксидантов и регуляторов иммунной системы. Если учесть, что мелатонин синтезируется также лимфоцитами, а рецепторы мелатонина найдены в мембранах тимоцитов, это дополнительно свидетельствует о значительном влиянии на функцию иммунной системы [5].
В организме человека мелатонин принимает участие в формировании многих патологических событий, включая канцерогенез и старение, когда отмечается снижение уровня данного гормона. Кроме того, уровень мелатонина в крови снижен у хронических курильщиков и у людей с повышенным индексом массы тела.
Свойства мелатонина:
· снижается температура тела;
· уменьшается уровень стрессовых гормонов и эмоциональное напряжение;
· возникает сонливость, наступает сон;
· падает давление крови, замедляется ритм сердечных сокращений;
· расслабляются мышцы;
· тормозится работа органов пищеварения и половой системы;
· восстанавливаются обменные процессы в головном мозге, происходит обработка информации, полученной за день.
Концентрация гормона достигает максимума к полуночи, держится на высоком уровне до 5 часов утра. Максимальные показатели гормона в детском возрасте, затем в период полового созревания они снижаются и вновь возрастают у молодых людей 20-23 лет. После 50 лет начинается прогрессивное уменьшение синтеза гормона и к 65 годам его в крови содержится на 20% меньше, чем у 45-летних [1].
Локальная мелатонинергическая система обнаружена в коже животных и человека. Мелатонин кожи участвует в процессах роста и пигментации волос, защищает клетки от воздействия ультрафиолета и других экзогенных и эндогенных повреждающих факторов.
Созданный в качестве фармакологического препарата мелатонин обнаружил необычайно широкий диапазон лечебных возможностей, которые оказались востребованы при различных патологических состояниях головного мозга и внутренних органов. Многие из них (церебральный отек, поражения желудочно-кишечного тракта, болевой синдром и др.) неизменно сопровождает воспаление, ограничение которого могло бы служить одной из целей терапевтического воздействия мелатонина. Это обстоятельство побудило обобщить факты, свидетельствующие и наличии у мелатонина противовоспалительных свойств, а также изучить данные свойства в ходе эксперимента [3].
Противовоспалительные возможности мелатонина
Способность мелатонина ограничивать воспалительный процесс определяется, по-видимому, совокупностью механизмов, имеющих как регионарное, так и системное происхождение. К числу местных факторов можно отнести прямое влияние мелатонина на отдельные компоненты воспалительной реакции, изменение иммунной реактивности и ограничение оксидантного стресса.
Одним из важнейших элементов антиэкссудативного действия мелатонина следует признать его вмешательство в каскад арахидоновой кислоты с нарушением синтеза простагландинов. Этот факт был установлен в опытах in vitro еще в начале 80-х годов прошлого века. Уже тогда обращалось внимание, с одной стороны, на сходство ингибиторных эффектов мелатонина и индометацина, а с другой – на вероятность их реализации в мозговой ткани (медиобазальном гипоталамусе) крыс [3,4].
Позднее на модели провоцируемой липосахаридом гипертермии и активации макрофагов было показано, что противовоспалительная активность мелатонина не зависит от непосредственного влияния на простогландиновые рецепторы, но определяется угнетением функции фермента циклооксигеназы (ЦОГ), индуцибельная изоформа которой – ЦОГ-2, являясь ключевым этапом в биосинтезе простогландинов, играет, как известно, критическую роль в воспалительном ответе при разных формах патологии.
Синтез индольного соединения мелатонина в секреторных клетках шишковидной железы - пинеалоцитах - происходит в несколько этапов. Исходным звеном является триптофан, который через серотонин и N-ацетилсеротонин превращается в конечный гормон. Ключевыми ферментами синтеза являются N-ацетилтрансфераза и гидроксииндол-O-метилтрансфераза. Образующийся мелатонин секретируется главным образом в спинномозговой жидкости, из которой он попадает в сосудистое русло, а затем переносится по всему организму кровотоком. В структурах головного мозга и периферических органах действие гормона осуществляется через специфические рецепторы (в основном, типов MT1 и MT2) [5].
Показательно, что образование эпифизарного мелатонина, вне в зависимости от видовых особенностей животных, максимально выражено в темноте и минимально на свету. Это обстоятельство дает основание рассматривать шишковидную железу как важную хронотропную железу, которая благодаря тесным морфофункциональным связям с драйвером циркадного ритма - супрахтмическими ядрами гипоталамуса - циркадными колебаниями различных физиологических функций. Учитывая факт преобладающей секреции мелатонина в темноте, они стали приписывать непосредственный интерес формированию цикла сна-бодрствования. В результате мелатонин приобрел репутацию естественного организатора биологических ритмов - хронобиотика и природного гипногенного агента.
В 70-е годы минувшего века иммуногистохимическая техника позволила установить наличие наряду с эпифизарным собственного мелатонина в различных периферических тканях. Содержащие его, в большинстве своем энтерохромаффинные, клетки принадлежат к ряду апудоцитов и наиболее полно представлены в различных элементах желудочно-кишечного тракта [4].
Как и в эпифизе, внеэпифизарный мелатонин проходит аналогичные этапы синтеза при участии тех же ферментов. Знаменательно, что его общее количество в ткани этих органов в десятки раз превосходит уровень плазменного мелатонина эпифизарного происхождения. После удаления эпифиза исчезают суточные колебания содержания гормона в плазме крови, но за счет периферических клеточных элементов в дневные часы он продолжает в определенном количестве удерживаться в сосудистом русле.
Влияние мелатонина на воспалительный процесс
Существует ряд клинических и экспериментальных данных о влиянии мелатонина на различные патологические состояния, связанные с воспалением. Среди них воспалительные поражения суставов, внутренних органов (например, язвенный колит), периферических нервов. Следует сразу подчеркнуть, что такие факты не всегда однозначно указывают на клиническую эффективность препарата [3,5].
Прежде всего, по наблюдениям отдельных исследователей, повторное введение препаратов мелатонина пациентам с ревматоидным артритом может успешно дополнить базовую терапию и повысить ее эффективность. Так, при ежедневном применении (3 мг в сутки) описано более выраженное ослабление утренней скованности, уменьшение количества опухших и болезненных суставов. Клиническое улучшение коррелировало с нормализацией ночного сна и перестройкой ритма суточной секреции кортизола. При более высокой дозе (10 мг) мелатонин наряду с некоторым ограничением симптомов ревматоидного артрита значительно оптимизировал антиоксидантный статус у пациентов. Многочисленная информация также представлена ??о способности мелатонина (3-6 мг) снимать головные боли различного происхождения. У людей и животных мелатонин также ограничивал ототоксическое действие аминогликозидных антибиотиков, оптимизировал лечение пациентов с ожогами, а при длительном (6-12 месяцев) применении улучшал состояние пациентов с язвенным колитом. В то же время имеются данные о способности мелатонина в некоторых случаях обострять течение ревматоидного артрита у пациентов и при его экспериментальном моделировании на животных [5].
Учитывая преобладание информации, указывающей на ограничение воспалительных проявлений мелатонина, вводимого извне, следует признать, что важно искать связь между уровнем эндогенного мелатонина и выраженностью симптомов. Однако результаты этого поиска еще не дают однозначных выводов. Согласно одной информации, радиоиммунное определение уровня гормонов плазмы у пациентов с ревматоидным артритом в ночное время указывает на снижение его значения по сравнению со здоровыми людьми, и, согласно другим данным, ревматоидный артрит и анкилозирующий спондилит, напротив, сопровождаются, напротив, увеличение секреторной активности шишковидной железы. Однако есть указание на то, что при патологии, в отличие от нормы, кривая суточной выработки мелатонина выглядит иначе, поскольку пик его содержания в плазме смещается вперед на несколько часов. Однако защитный, адаптивный характер эпифизарной гиперактивности в ответ на первичное воспалительное поражение не исключен.
Цель исследования:
Определение противовоспалительной активности мелатонина на модели «каррагенинового» отека лапы у крыс.
Материалы и методы
Изучение противовоспалительной активности мелатонина проводили на модели «каррагениновый отёк лапы» у крыс. Эксперименты выполнены на 30 белых неинбредных крысах средней массой 325,97±1,2 г. Подопытных животных содержали в условиях вивария (с естественным режимом освещения; при температуре 22–24; относительной влажности воздуха 40–50 %) с использованием стандартной диеты (ГОСТ Р 50258-92). Исследования проводили в соответствии с правилами качественной лабораторной практики (GLP) при проведении доклинических исследований в РФ, а также правилами и Международными рекомендациями Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1986).
Противовоспалительную активность мелатонина оценивали в экспериментах на модели «каррагенинового» отека лапы. Острую воспалительную реакцию (отек) воспроизводили субплантарным (под подошвенный или плантарный апоневроз) введением 0,1 мл 1% раствора каррагенина (сульфатированный полисахарид из ирландского морского мха) [2]. Выраженность воспалительной реакции оценивали через 3, 12 часов после индукции воспаления по изменению объема лапы (онкометрически). Исследуемые вещества наносили на лапы крыс в виде мази. Противовоспалительный эффект, оцениваемый по уменьшению отека, выражали в процентах по отношению к контролю.
В качестве исследуемого вещества был выбран мелатонин в составе двух препаратов: Мелатонин + L-теанин 200 мг (Производитель: Nature Made) и Мелаксен (Производитель: Юнифарм) . Исследуемые вещества наносили на лапы крыс в виде мази, изготовляемой непосредственно перед экспериментом путем добавления измельченных препаратов к мазевой основе (10% раствор Натрий –КМЦ). Препаратом сравнения был выбран Диклофенак– стандартное НПВС.
Подопытные животные были разделены на 4 группы (по 6 крыс в каждой):
1) Крысы, получавшие Мелатонин с теанином в дозе 10 мг/мл – 0,1 мл;
2) Крысы, получавшие Мелаксен в дозе 10 мг/мл – 0,1 мл;
3) Крысы, получавшие Диклофенак в дозе 10 мг/мл – 0,1 мл;
4) Крысы контрольной группы
Результаты
Было выявлено, что при субплантарном введении 0,1 мл 1 % раствора каррагенина у подопытных крыс развивается выраженный отек лапы, о чем свидетельствует достоверное увеличение ее объема. Отмечено, что максимальный отёк лапки (пик воспаления) развивался через 3 часа после введения каррагенина, при этом объем лапы у подопытных животных контрольной группы увеличивался в среднем на 82,5 %±5,7%.
При нанесении НПВС Диклофенака показатель прироста объема лапы составил 28,33±5,4% через 3 часа после индукции воспаления и нанесения препарата по сравнению с фоновым значением. При нанесении препаратов мелатонина это значение составило в среднем 52,08±7,7%. Также были найдены достоверные отличия между мелатонинсодержащими препаратами: прирост объема лапы крысы при применении Мелатонина с L-теанином составил 63,33±5,4%, Мелаксена – 40,83±9,9%.
При онкометрическом измерении объема лап крыс через 12 часов после индукции воспаления и нанесения препаратов достоверно наблюдалось уменьшение объема лап крыс по сравнению с измерениями через 3 часа после индукции воспаления: при нанесении Диклофенака на 15,33±2,4%; мелатонинсодержащих препаратов - на 23,33±5,6% в среднем. Причем показатели мелатонинсодержащих препаратов достоверно отличались между собой, при нанесении Мелатонина с L-теанином объем лап крыс уменьшился на 26,63±5,8%, при нанесении Мелаксена – на 20,03±5,3%.
Показатели объема лапы крыс в мл. (Таблица №1):
|
Название препарата |
Объем лапы крысы, мл. |
||
|
Фон |
Через 3 часа |
Через 12 часов |
|
|
Мелатонин+теанин |
0,96 |
1,59 |
1,33 |
|
Мелаксен |
0,92 |
1,33 |
1,13 |
|
Диклофенак |
0,98 |
1,27 |
1,08 |
|
Контрольная группа |
1,06 |
1,88 |
1,23 |
Таб.1 Объемы лап крыс
Прирост объема лапы крысы в процентном отношении (Таблица №2):
|
Название препарата |
Прирост объема лапы крысы, % |
|
|
Через 3 часа |
Через 12 часов |
|
|
Мелатонин+теанин |
63,33 |
36,70 |
|
Мелаксен |
40,83 |
20,80 |
|
Диклофенак |
28,33 |
13,00 |
|
Контрольная группа |
82,50 |
17,50 |
Таб.2 Прирост объема лапы в процентном отношении
Показатели объема лапы крыс в процентном отношении (Диаграмма №1):
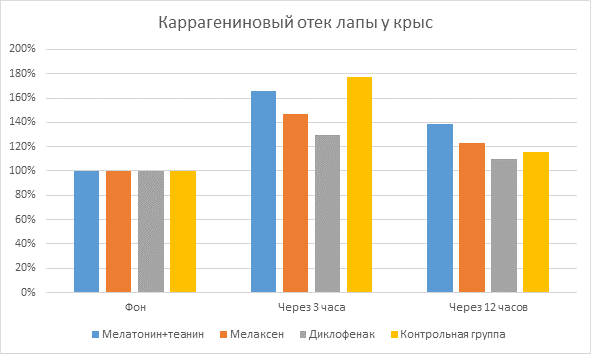
Диаграмма 1. Показатели объема лапы крыс в %
Выводы: на основании данных онкометрических измерений при индукции «каррагенинового» отека лап у крыс показано, что мелатонин обладает выраженным противовоспалительным действием.

