Введение
Применение аппаратов искусственного кровообращения в кардиохирургии стало на сегодняшний день достаточно распространенной практикой. Но, несмотря на накопленный клинический опыт, этот метод остается небезопасным. Главным образом это связано с применением донорской крови. В результате её использования возникают различные осложнения, для устранения которых многие исследователи искали альтернативные растворы для первичного заполнения АИК [1]. Также немаловажную роль в развитии осложнений в послеоперационный период играют физиологические, технические, хирургические и деонтологические аспекты.
С течением времени аппараты искусственного кровообращения постоянно модифицировались, появились дополнительные устройства, позволяющие минимизировать повреждающее действие на организм, такие как оксигенаторы, экстракорпоральные контуры с минимальным первичным объемом заполнения, изготовляемые из биосовместимых материалов.
Но, несмотря на все достижения кардиохирургии в этом направлении до сих пор высок риск послеоперационных осложнений, так как эта процедура расстраивает все звенья гомеостаза.
Пациентом современной кардиохирургической клиники всё чаще становится человек, находящийся в очень тяжелом состоянии: новорожденный, ребёнок с малым весом или тяжелым врожденным пороком сердца или же взрослый, подвергающийся повторному хирургическому вмешательству или имеющий сопутствующие патологии [2].
Главной целью перфузиолога, как и много лет назад, является обеспечение наибольшей безопасности пациента во время проведения операции и минимизация послеоперационных осложнений.
Цель исследования
Целью работы является проведение анализа литературных источников, научных статей и статистических данных по вопросу применения аппарата искусственного кровообращения в кардиохирургической практике.
Материалы и методы исследования
Материалами исследования послужили научные публикации отечественных и зарубежных ученых, опубликованные за последние 10 лет.
Результаты исследования и их обсуждение
Перфузиология – интенсивно развивающаяся отрасль медицины, которая изучает использование аппарата искусственного кровообращения при оперативных вмешательствах на сердце, которые предполагают выключение сердца из кровообращения.
Первые аппараты искусственного кровообращения (АКИ) были применены в клинической практике более 60 лет назад, причем довольно-таки успешно. С развитием кардиохирургии аппараты для перфузии длительно совершенствовались, многократно модифицировались и корректировались; в практику вводились новые методы искусственного кровообращения.
Создателем первого АИК считается советский ученый-патофизиолог С.С. Брюхоненко. В 20-е годы XX века он подробно изучал механизмы терморегуляции и причины повышения температуры тела. На основании полученных данных Брюхоненко разработал методику «переживания» головы собаки, отделенной от тела, с помощью так называемого автожектора, который со временем был запатентован в Англии, Франции и Германии. Сначала автожектор применялся для выведения организма из состояния клинической смерти, а с 1929 года он стал использоваться и для экспериментальных операций на сердце с отрытым доступом. Идея оживления после наступления клинической смерти нашла практическое применение в методиках вспомогательного кровообращения [4].
Первая успешная операция на человеке с выключением сердца из кровообращения при ушивании дефекта между предсердиями была проведена 6 мая 1953 года. В России же операции, проводимые с использованием АИК вошли в практику чуть позже, в 1957 году (первые операции были проведены под руководством А.А. Вишневского).
Тем не менее, долгое время подобные операции не находили широкого применения ввиду большого количества недостатков аппарата и высокими показателями послеоперационных осложнений. АИК для своего заполнения требовал до 4-6 литров донорской крови, аппараты были крайне ненадежны, так как физиологические узлы аппарата использовались многократно, да и способы управления таким устройством были крайне тяжелыми.
С момента первой операции аппараты постоянно усовершенствовались, появились оксигенаторы с минимальными первичными объемами заполнения; кроме того постоянно внедрялись новые биосовместимые материалы. Все это минимизировало неблагоприятное воздействие перфузии на организм. Разработка и внедрение гемодилюции (Panico F., Neptune W., 1959 г.), гипотермии в сочетании с искусственным кровообращением (Sealy W., 1958 г.) и защиты миокарда (Melrose D.G., 1955 г.) способствовали оптимизации перфузионных протоколов и повлекли за собой ряд фундаментальных исследований, посвященных изучению патофизиологических и клинических аспектов этих направлений [3].
АИК состоит из двух блоков: механического и физиологического. Механический блок включает в себя собственно сам АИК, который имеет центрифужные и роликовые насосы [7], электронные системы контроля (температуры, давления, уровня в кардиотомном резервуаре, пузырьков воздуха) и безопасности. Главным узлом механического блока является артериальный насос, замещающий функцию сердца и регулирующий минутный объем крови. Другие роликовые насосы используются в качестве коронарных отсосов, для нагнетания раствора, а также осуществляют ультрафильтрацию [4].
Физиологический блок состоит из одноразового экстракорпорального контура, выполняющего роль оксигенатора, то есть замещающего легкие. Его основная функция заключается в насыщении крови кислородом и выведении углекислого газа. Для пациентов разных возрастных и весовых категорий применяются оксигенаторы с различной максимальной производительностью и разными объёмами первичного заполнения. ЭК-контур состоит из кардиотомного резервуара, который может быть как жестким, так и мягким; насосного сегмента; теплообменника; артериального фильтра-ловушки; двух или трех магистралей для отсосов и артериальной/венозной линий.
Перед тем, как начать искусственное кровообращение, ЭК-контур заполняют, диаэрируют, и только после этого подсоединяют к сердечно-сосудистой системе [9].
Существуют различные схемы и методы подключения ЭК-контура к сердцу, в зависимости от патологической причины, которую будут устранять во время операции. При стандартном подсоединении используется следующая схема: верхняя полая вена (ВПВ), нижняя полая вена (НПВ), аорта (Ао) (рис. 1a).
Рисунок 1
Схемы подключения ЭК-контура к сердцу: а – стандартная, б – двухсекционная, в - обходная.
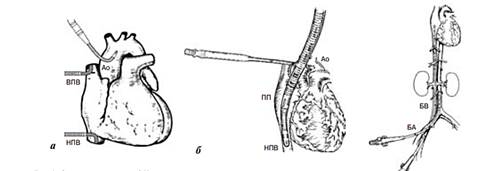
При проведении операций без вскрытия камер сердца или при остановке кровообращения с глубокой гипотермией считается достаточным применение одного венозного катетера. Также существует метод двухсекционного подключения, при котором один порт забора подсоединяют к сердцу на уровне правого предсердия, а другой – на уровне нижней полой вены. (Рис. 1б). В случаях, когда операцию проводят на аорте, а именно на восходящей её части или дуге, а также при повторных вмешательствах канюлю присоединяют к бедренной артерии. (Рис 1в).
Редкими случаями подключения являются бедренно-бедренный метод канюлирования и метод левожелудочкового обхода. Последний метод широко используется при реконструктивных операциях торакоабдоминального отдела аорты, для создания частичного сердечно-легочного обхода.
Для определения размера аортальных канюль, использующихся при присоединении ЭК-контура, учитывают максимальный минутный объем кровообращения индивидуальный для каждого конкретного пациента, а также пропускную способность канюли определенного диаметра. Выбор диаметра венозного катетера зависит от массы тела пациента и от диаметра полых вен, который хирург определяет визуально. В норме диаметр катетера должен быть не более 2/3 от просвета сосуда.
Если невозможно обеспечить адекватный венозный отток крови, в частности из-за низкой пропускной способности катетеров, применяют технику вспомогательного венозного дренажа. Эта методика является эффективной и безопасной благодаря тому, что улучшается венозный возврат без изменения градиента между кардитомным резервуаром и правыми камерами сердца, не травмируются форменные элементы крови, а также не происходит образование микроскопических эмболов.
Как только хирург подключил катетеры к магистральным сосудам, начинается перфузия. Существует две её разновидности: параллельная и полная. Параллельной перфузия считается до момента пережатия полых вен и, соответственно, прекращения притока крови к сердцу, а полной – после пережатия полых вен.
После снятия турникетов с полых вен и зажима с аорты начинается параллельная перфузия, которая может проводиться с полными объемными скоростями, когда необходимый минутный объем крови обеспечивается аппаратом искусственного кровообращения, и во вспомогательном режиме, когда часть минутного объема крови обеспечивается работой сердца, а часть – производительностью артериального насоса.
Составы первичного объема заполнения (прайма) разнообразны и зависят от многих показателей (объема циркулирующей крови, возраста и массы тела пациента, исходного гематокрита и т. д.). К основным компонентам прайма относят кристаллоидные и корригирующие растворы (KCl, NaHCO3), эритроцитарную массу, гепарин, растворы естественных (альбумин, сверхзамороженная плазма) и синтетических коллоидов (гидроксиэтилкрахмал и производные желатины), маннитол, апротинин и антибиотик [5].
АИК оказывает негативно воздействие на организм, вызывает гипероксию, гипотермию, гемодилюцию; его использование повреждает форменные элементы крови и запускает воспалительный процесс; кроме того при его использовании кровоток становится непульсирующим, что приводит к нарушению постоянства внутренней среды организма [4].
В результате этого развивается синдром системной воспалительной реакции (ССВР), к его развитию приводят активация фибринолиза, коагуляции, системы комплемента и калликреин-кининовой системы. Активируются тромбоциты и лейкоциты, повреждаются клетки эндотелия сосудов. Все это приводит к увеличению проницаемости сосудов, накоплению жидкости в интерстициальном пространстве, нарушению микроциркуляции и гипоперфузии ткани с морфофункциональными изменениями [6]. Могут возникнуть такие осложнения, как кровотечение и повреждение легких.
Клиническими проявлениями чрезмерного иммунного ответа является постперфузионный синдром, включающий в себя лихорадку, респираторные нарушения, почечную недостаточность, коагулопатии, дисфункцию миокарда и неврологические осложнения. Новорожденные и дети первого года жизни наиболее подвержены негативным влияниям переливания крови, это связано с морфофункциональными особенностями молодого организма и незрелостью иммунной системы.
Достижением перфузионных технологий является применение мини-контуров, гепариновых и биосовместимых покрытий. Применение мини-контуров без кардиотомных резервуаров позволили сократить контактную поверхность и уменьшить нарушение целостности ткани [8]. А это в свою очередь исключает возникновение ССВР за счет повышения биологической совместимости применяемых материалов, так как уменьшается контакт с чужеродной поверхностью.
Усовершенствованные оксигенаторы минимально травмируют форменные элементы и белки крови, а также обеспечивают оптимальный газовый состав.
Инновационными внедрениями в технику перфузии стали лейкодеплеция (уменьшение числа лейкоцитов) и ультрафильтрация, а также добавление в прайм (первичный объем заполнения) кортикостероидов, донорских NO-соединений и апротинина. Активированные лейкоциты повреждают эндотелий сосудов, поэтому их непрерывное удаление из переливаемой крови предотвращает возникновение воспалительного процесса. Также с донорскими лейкоцитами возможен перенос различных вирусных заболеваний (ВИЧ-инфекция, гепатиты B и C). В связи с этим для удаления лейкоцитов применяют специальные фильтры, гидрофильная синтетическая поверхность которых имеет высокое сродство к лейкоцитам, что обеспечивает высокую степень очистки.
Для новорожденных и маловесных детей разрабатываются педиатрические ЭК-контуры, которые позволяют не только уменьшить контактирующую поверхность, но и минимизируют первичный объем заполнения этих систем вплоть до полного отказа от компонентов донорской крови.
Значительный вклад в развитие кардиохирургии принесло внедрение гипотермии в процесс искусственного кровообращения. Гипотермия оказывает на организм как положительные, так и отрицательные воздействия. К положительным характеристикам гипотермии, улучшающим показатели гемодинамики при применении аппарата искусственного кровообращения, относятся снижение интенсивности метаболических процессов и потребности организма в кислороде. Благодаря этому увеличивается устойчивость организма к гипоксии. За счет увеличения растворимости газов и снижения парциального давления углекислого газа в крови наблюдается сдвиг кислотно-щелочного равновесия в кислую сторону. К отрицательным эффектам относятся централизация кровообращения за счет резкого снижения скорости кровотока в мышцах, коже и жировой ткани, повышение вязкости крови, а также увеличение сродства гемоглобина к кислороду, благодаря сдвигу кривой диссоциации оксигемоглобина влево.
Метаболизм катехоламинов в организме значительно снижается при гипотермии, в результате чего кровоснабжение сердечных и скелетных мышц ухудшается. При полной перфузии из кровотока выключаются легкие, что также негативно влияет на организм, так как в них происходит инактивация многих гормонов и вазоактивных веществ.
В современной кардиохирургии имеется тенденция к ограничению использования низких температур, однако в хирургии сложных врожденных пороков сердца гипотермическая перфузия по-прежнему остается предпочтительным методом [5].
Заключение
Современные технологии позволяют минимизировать негативное влияние АИК на организм человека и значительно снижают риск возникновения послеоперационных осложнений. Общей тенденцией в дальнейшем совершенствовании аппаратов является модифицирование физиологического блока для одноразового пользования, микропористых фильтров в артериальной линии и переход к мембранным оксигенаторам.
Своевременная диагностика расстройств, возникающих во время и после проведения перфузии, является одним из главных элементов, на основании, которого проводятся многочисленные эксперименты по улучшению и повышению качества перфузии. Большинство признаков адекватности перфузии являются интегральными показателями, характеризующими «среднее» состояние организма. Поэтому мнение В.П. Осипова (1971 г.) о том, что «состояние кровотока на уровне микрососудов является прямым признаком качества перфузии» и что «ряд признаков адекватности перфузии достоверны только при отсутствии нарушений микроциркуляции», особенно актуально сегодня, когда наши возможности понять и оценить параметры микроциркуляции значительно расширились.

