В 1970-х годах молодой немецкий иммунолог Георг Келер изучал генетическую изменчивость антител. Для исследования надо было изолировать клон антителообразующих клеток (АОК) – плазматических клеток (производных от В-лимфоцитов). Необходимо отметить, что В-лимфоциты могут жить только в организме хозяина, и в искусственной питательной среде они быстро гибнут. Их длительное культивирование вне организма невозможно. Наоборот, клетки опухоли из плазматических клеток, называющиеся плазмоцитомами или миеломами, хорошо культивируются и размножаются in vitro и их называют «бессмертными».
Георг Келер Цезарь Мильштейн
Для реализации проекта Келер поехал в Англию, в лабораторию Цезаря Мильштейна, изучавшего клоны плазмоцитом, и они вместе разработали оригинальный подход к этой проблеме: решили получить гибрид нормальной антителообразующей клеткой (АОК) и опухолевой клетки. В случае успеха такой гибрид унаследовал бы от нормальной клетки способность к синтезу антител, а от опухолевой – бессмертие и способность к неограниченному и бесконтрольному росту. Это им удалось осуществить, создав гибридомную технологию.
Метод гибридизации соматических клеток in vitro осуществляется путем слияния разнородных клеток. Разнородные клетки, у которых слились оболочки, образовывали гибриды, которые сохраняли способность к клеточным делениям. Таким образом, возникал истинный гибрид, потомок двух соматических клеток, или гибридома. Келер и Мильштейн получили гибридому между нормальной АОК и опухолевой, миеломной клеткой.


Моноклональные антитела (МАТ) – это антитела лабораторного производства, связывающиеся с конкретными антигенами, например, с рецепторами раковых клеток, и при этом отсутствующие у нормальных клеток. Для создания МАТ мышам вводят раковые клетки человека, затем клетки селезенки, продуцирующие антитела, сливают с клетками мышиной миеломы, получая гибридную клетку – гибридому, которая путем деления производит идентичные дочерние клетки или клоны – отсюда термин «моноклональные». Антитела, секретируемые различными клонами, проверяются на способность узнавать свой антиген. С помощью этих бессмертных клеток гибридом могут быть получены большие количества антител. Поскольку антитела мыши могут сами вызывать иммунный ответ у людей, в мышиных антителах часто заменяют большую часть мышиного антитела на человеческие [1,3,4].
Для получения больших объемов жидкости, содержащей моноклональные антитела, гибридомы могут быть введены внутрибрюшинно мышам реципиентам. В результате в брюшной полости вырастает солидная опухоль и накапливается асцитическая жидкость, являющаяся источником моноклональных антител. Полученные клоны можно заморозить при -700С и длительно сохранять. Их можно культивировать и накапливать антитела в культуральной среде, а можно привить мышам, где они будут расти и накапливать колоссальные количества моноклональных антител. От одной мышки можно получить антител не меньше, чем от кролика. Эти антитела не содержат посторонних антител и настолько однородны, что могут рассматриваться как чистые химические реагенты.
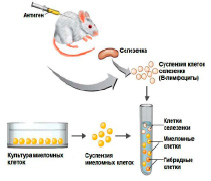
Таким образом, клоны-продуценты моноклональных антител (гибридомы) получают слиянием антителообразующих клеток лимфоидной ткани иммунизированного животного и клеток плазмацитомы. Полученные в результате клетки наследуют от лимфоцитов способность к секреции антител и от клеток миеломы способность к неограниченному росту in vitro [5].
В терапии опухолей используют два типа МАТ: простые (не связанные ни с какими цитотоксическими веществами) и конъюгированные – МАТ, лечебный эффект которых обусловлен присоединенными к антителу веществами (радиоактивными частицами, цитостатиками или токсинами). Механизм терапевтического действия антител можно рассмотреть на примере алемтузумаба – МАТ против антигена лимфоцитов CD52, обладающих противоопухолевым и иммуносупрессивным действием, направленного на лечение хронического лимфолейкоза и кожной Т-клеточной лимфомы. Вариабельный регион алемтузумаба соединяется с антигеном CD52 на поверхности лимфоцитов, а константный регион – с Fc-рецепторами на поверхности цитотоксических клеток, которые уничтожают мишень. Кроме того, препарат активирует систему комплемента, что приводит к образованию комплекса, разрушающего мембрану злокачественной клетки. Именно эти два механизма, а также индукция апоптоза считаются основными в действии МАТ. Характер иммунотерапии зависит от разновидности опухоли. Так, при раке легкого используется авастин – гуманизированное рекомбинантное гиперхимерное моноклональное антитело, которое селективно связывается с биологически активным фактором роста эндотелия сосудов, нейтрализуя его [2].
Действие mAb на клетку опухоли:
1 – антитело mAb связывается с антигеном опухолевой клетки и вызывает или ее комплемент-зависимую гибель, или гибель в результате антителозависимой атаки макрофагами.
2 – с mAb связан радиоактивный изотоп, токсин или цитокин, вызывающие гибель клетки. Также с антителами может быть связан фермент, участвующий в превращении препарата в активную форму.
3 – биспецифические mAb. Один сайт связывается с опухолевой клеткой, другой – с киллерной эффекторной клеткой.
4 – антитела mAb связаны с липосомами, которые содержат химотерапевтические препараты или токсины.[6]
Разработка новых моноклональных антител и совершенствование схем терапии злокачественных опухолей с их помощью является одним из наиболее перспективных направлений в онкологии, дающих больше шансов на продление активных лет жизни онкологическим больным.

