Кадмий интенсивно используется в электрогальванике, как стабилизатор пластмасс, как пигмент в красках и в никеле-кадмиевых батареях. Как контаминат он входит в состав фосфатных удобрений и присутствует в осадках сточных вод [1].
Его концентрации в воздухе колеблются от неопределяемых количеств в непромышленных районах до 0,06 г/м3 в районах с развитой промышленностью.
Его концентрации в пище определяются местом ее выращивания и видимым загрязнением почв этих районов. Согласно рекомендациям ФАО/ВОЗ, допустимая суточная доза кадмия для человека равна 0,4–0,5 мг. Благодаря относительно продолжительному сроку биологического полувыведения кадмия возможны два типа отравления острое и хроническое.
Продолжительное вдыхание кадмия при курении может привести к патологическим изменениям в легких и внести свой вклад в развитие эмфиземы. Продолжительное поступление кадмия в организм вызывает экспериментальную гипертензию у многих видов животных. Однако, связь кадмия с гипертонией у человека все еще не подтверждена окончательно.
Относительно большие дозы вызывают геморрагию и последующий некроз, предотвратить который может профилактическое употребление селена и цинка [2].
Кадмий является, по крайней мере, одним из основных факторов, вызывающих болезнь Итай-итай. Основными свидетельствами того, что кадмий служит причиной заболевания, являются:
1) распространение заболевания ограничивалось бассейном реки Джинзу в Японии, в котором вода, почвы и выращиваемый на них рис были сильно загрязнены кадмием, свинцом и цинком;
2) больше всего случаев заболевания наблюдалось при более серьезных загрязнениях окружающей среды;
3) концентрации кадмия в моче и аутопсических пробах печени у больных итай-итай были выше, чем у контрольных субъектов. Итай-итай представляет собой вид размягчения костей (остеомаляции) и получила свое название от жестоких болей, которые возникают при вызываемых ею переломах. При ней также наблюдаются не менее тяжелые почечные дисфункции [2, 3].
Кадмий токсичен почти для всех систем организма человека и животных. Гистологические изменения наблюдались в почках, печени, желудочно-кишечном тракте, сердце, яичках, поджелудочной железе, костях и кровеносных сосудах [3].
Трудно объяснить токсичность кадмия в точных биохимических терминах. Кадмий связывается с сульфидными группами, фосфолипидами, нуклеиновыми кислотами и, разобщает процесс окислительного фосфорилирования.
Несмотря на то, что кадмий признан одним из самых токсичных веществ, он нашел применение и в медицине. Так, введенная в грудную клетку пациента, страдающего сердечной недостаточностью, никель-кадмиевая батарейка обеспечивают энергией механический стимулятор работы сердца. Удобство такого аккумулятора заключается в том, что для его подзарядки или замены больному не придется ложиться на операционный стол. Для бесперебойной службы батарейки достаточно раз в неделю надевать всего на полтора часа специальную намагниченную куртку.
Кадмий применяется в гомеопатии, экспериментальной медицине, а совсем недавно его стали использовать при создании новых противоопухолевых препаратов.
Кадмий относится к группе высокотоксичных элементов, что обуславливает изучение его влияния на микроорганизмы рода Bacillus, которые по своей природе относятся к группе почвенных микроорганизмов.
Для реализации поставленной задачи в качестве объектов исследования нами были использованы 6 пробиотических препаратов на основе бактерий рода Bacillus: Споробактерин (B. subtilis 534), Бактисубтил (B. cereus IP 5832), Ветом 1.1 (B. subtilis 10641), Ветом 2 (B.licheniformis 7038), Ветом 3 (B. amyloliquefaciens 10642), Ветом 4 (B. amyloliquefaciens 10643). В качестве регулирующих факторов в работе использовались различные соли (нитраты, хлориды, сульфаты, ацетаты и оксиды) кадмия.
Для выполнения данного этапа работы использовали метод агаровых лунок, выбор данного метода объясняется тем, что он позволяет не только визуально но и качественно оценить влияние тяжелых металлов на рост исследуемых микроорганизмов.
Методика выполнения заключается в следующем: изучаемый микроорганизм высевали сплошным «газоном» на поверхность агаровой пластинки (1,5% МПА) в чашке Петри. После этого, пробочным сверлом (диаметр 5 мм) вырезали агаровые блочки, при этом на одной чашке Петри можно разместить до 7 агаровых лунок в которые в последующем вносили исследуемые концентрации веществ для оценки их ингибирующего и субингибирующего эффекта. Чашки помещали в термостат на 24 часа при температуре 37 °C (благоприятной для развития исследуемого тест-организма). После инкубирования производили визуальную оценку действия исследуемого металла на рост популяции. Отсутствие зон подавления роста свидетельствовало о отсутствии влияния либо соли в целом (как правило данное явление отмечалось у солей с низки уровнем диссоциации), либо определенной концентрации (именно такие концентрации в дальнейшем использовались в качестве рабочих). В том случае если исследуемое вещество обладало высокой активностью в отношении исследуемого микроорганизма регистрировали значительные зоны подавления роста вокруг лунки.
В ходе проведенных исследований было установлено, что, как и в случае с цинком, избыточное содержание кадмия не оказывает бактерицидного эффекта на исследуемые микроорганизмы (см. рис.) при этом по мере снижения концентрации отмечается значительное ингибирующее действие катионов на бактериальные штаммы. В ходе исследований установлено, что наиболее чувствительным штаммом является B. subtilis 534, при этом наиболее выраженным бактерицидным эффектом обладает хлорид кадмия. Наиболее резистентным является B. cereus IP 5832 как в отношении хлорида, так и в отношении ацетата кадмия.
Данные по изучению влияния кадмия на рост исследуемых микроорганизмов представлены в таблице.
Исходя из выше представленных данных следует о менее выраженном токсическом влиянии исследуемых солей кадмия по сравнению с влиянием анионных компонентов железа и цинка в отношении изучаемых пробиотических штаммов.
Следует выделить, что наиболее выраженным токсическим эффектом в отношении исследуемых микроорганизмов обладает хлорид кадмия, значения зон подавления роста, которых, превысили значения ацетата и сульфата кадмия для B. licheniformis 7048 на 62,1% и 39,9%, B. cereus 5832 на 12,5% и 32,5%, B. subtilis 10641 7,0% и 19,0%, соответственно.
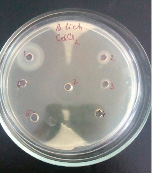
1) 
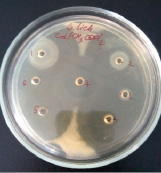
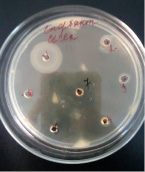
2) 
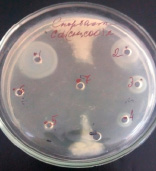
3) 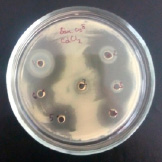
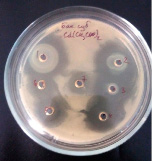
Влияние CdCl2 и Cd(CH3COO)2 на рост исследуемых микроорганизмов: 1 – B.licheniformis 7038, 2 – B. cereus IP 5832, 3 – B. subtilis 534
Оценка влияния солей кадмия на рост бактерий рода Bacillus
|
B. licheniformis 7048 |
|||||
|
1 Моль |
0,5 Моль |
0,25 Моль |
0,125 Моль |
0,063 Моль |
|
|
CdSO4 |
29,0±0,58 |
27,0±1,03 |
18,3±3,38 |
10,7±0,33 |
6,7±0,33 |
|
Cd(CH3COO)2 |
18,3±1,67 |
14,7±2,33 |
10,0±0,00 |
– |
– |
|
CdCl2 |
48,3±1,67 |
48,3±1,67 |
20,7±1,21 |
11,0±3,67 |
23,3±1,67 |
|
B. cereus 5832 |
|||||
|
CdSO4 |
27,0±1,53 |
23,3±0,67 |
13,7±0,33 |
10,0±0,00 |
– |
|
Cd(CH3COO)2 |
35,0±0,00 |
35,0±0,00 |
30,0±1,00 |
30,0±0,00 |
25,0±2,00 |
|
CdCl2 |
40,0±0,00 |
33,0±0,00 |
30,0±0,00 |
26,7±1,67 |
22,7±1,45 |
|
B. subtilis 534 |
|||||
|
CdSO4 |
28,3±0,88 |
23,3±0,88 |
15,0±0,58 |
10,7±0,67 |
7,7±2,40 |
|
Cd(CH3COO)2 |
25,0±0,00 |
21,0±2,08 |
12,7±0,67 |
8,0±1,00 |
5,8±1,33 |
|
CdCl2 |
20,0±0,00 |
15,0±0,00 |
10,00±1,00 |
5,3±1,33 |
– |
|
B. amyloliquefaciens 10642 |
|||||
|
CdSO4 |
26,0±1,00 |
21,3±0,67 |
13,3±0,67 |
9,3±0,88 |
6,3±0,33 |
|
Cd(CH3COO)2 |
24,7±0,33 |
27,7±3,33 |
15,3±1,67 |
13,3±3,33 |
25,3±2,91 |
|
CdCl2 |
25,7±2,33 |
23,3±1,82 |
19,3±1,36 |
15,0±2,66 |
25,0±2,88 |
|
B. subtilis 10641 |
|||||
|
CdSO4 |
26,7±0,88 |
22,7±0,67 |
11,7±0,88 |
9,3±0,67 |
6,0±1,46 |
|
Cd(CH3COO)2 |
30,7±0,67 |
30,0±0,00 |
21,7±1,67 |
26,7±2,33 |
14,0±3,02 |
|
CdCl2 |
33,0±1,66 |
30,0±0,00 |
28,3±1,01 |
22,3±1,45 |
21,7±1,67 |
|
B. amyloliquefaciens 10643 |
|||||
|
CdSO4 |
28,6±0,88 |
22,7±1,20 |
13,7±0,33 |
10,3±0,33 |
6,0±0,00 |
|
Cd(CH3COO)2 |
24,0±1,00 |
19,0±1,00 |
10,0±0,00 |
8,3±1,67 |
– |
|
CdCl2 |
20,0±0,00 |
15,0±0,00 |
10,0±1,00 |
6,0±1,00 |
– |
В ходе выполненных исследований было установлено, что в отношении сульфата кадмия наименее резистентными оказались штаммы B. licheniformis 7048, а по отношению к хлориду кадмия и ацетату кадмия B. licheniformis 7048 и B. cereus 5832, соответственно.

