Биологическая роль цинка многообразна. Он необходим для роста и деления клеток, развития костной ткани, процессов регенерации, репродуктивной функции, развития мозга и поведения. Являясь компонентом более 300 энзимов, цинк принимает участие во всех видах обмена, входит в состав генетического аппарата клетки, представляя около 100 цинксодержащих нуклеопротеидов. Цинк принимает активное участие в процессах регенерации, поскольку необходим для синтеза и стабилизации ДНК.
Как и в случае с медью, несмотря на то что цинк является биогенным (эссенциальным) элементом его избыточное содержание в окружающей среде может приводить к различным патологиям как у человека, так и у животных.
Металлический цинк и его соединения в производственных условиях поступают в организм главным образом через органы дыхания и частично через пищеварительный тракт в результате заглатывания пыли. Более всего изучено токсическое действие паров цинка и мелкодисперсного аэрозоля, которые образуются в процессе плавления металла оксида цинка. При их вдыхании в значительных концентрациях может возникать проф. заболевание – так называемая цинковая, или литейная лихорадка. При хроническом отравлении оксидом цинка могут развиться атрофические и субатрофические изменения слизистой оболочки верхних дыхательных путей, гипохромная анемия, желудочно-кишечные расстройства, нарушения сна, повышенная утомляемость, шум в ушах, снижение остроты слуха. При длительном воздействии пыли оксида цинка на организм человека возможно развитие медленно прогрессирующего пневмокониоза. При длительном вдыхании пыли оксида цинка в значительных концентрациях развиваются умеренные явления пневмосклероза и эмфиземы легких, реже – мелкопятнистая диссеминация в связи с отложением рентгеноконтрастной пыли оксида цинка в легких; возможна уробилинурия и порфиринурия. Раздражающим действием обладают также сульфат и стеарат цинка. Сухой сульфат цинка и его концентрированные растворы вызывают изъязвления кожи кистей рук, особенно их тыльной поверхности, по типу так называемых птичьих глазков. Получены экспериментальные данные об онкогенном действии цинка и его соединений. Острое отравление соединениями цинка отмечали при вдыхании оксида цинка в высоких концентрациях (например, при нагревании металлического цинка выше температуры его плавления). У пострадавших появляется сладковатый привкус во рту, через 1-5 часов возникает сильная жажда, болезненное стеснение в груди, сухой кашель, озноб и другие признаки литейной лихорадки. При вдыхании аэрозоля хлорида цинка может развиться отек легких. При отравлении растворимыми солями цинка через рот у пострадавших также отмечают металлический вкус во рту, наблюдается тошнота, слюнотечение. развивается ожог слизистой оболочки рта, пищевода, желудка, появляются рвота с примесью крови, боль в животе, понос, резкое возбуждение, непроизвольные подергивания отдельных групп мышц, судороги икроножных мышц, возможен коллапс и шок. При более длительном течении отравления развивается острая почечная недостаточность [1, 2, 3].
Значительные концентрации увеличения цинка наблюдаются в восточной части Оренбуржья, что напрямую связано в развитой горнодобывающей и металлургической промышленностью. При этом в ряде районов его содержание превышено в десятки раз по отношению к предельно допустимым концентрациям [4. 5].
Выше изложенное является критерием для изучения влияния свинца на рост микроорганизмов входящих в состав почв и пробиотических препаратов (см. рис.).
Для реализации поставленной задачи в качестве объектов исследования нами были использованы 6 пробиотических препаратов на основе бактерий рода Bacillus: Споробактерин (B. subtilis 534), Бактисубтил (B. cereus IP 5832), Ветом 1.1 (B. subtilis 10641), Ветом 2 (B.licheniformis 7038), Ветом 3 (B. amyloliquefaciens 10642), Ветом 4 (B. amyloliquefaciens 10643). В качестве регулирующих факторов в работе использовались различные соли (нитраты, хлориды, ацетаты и оксиды) свинца.
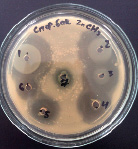
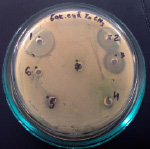
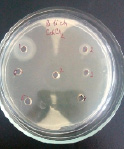
1 2 3
Влияние Zn(CH3COO)2 на рост исследуемых микроорганизмов: 1 – B. subtilis 534, 2 – B. cereus IP 5832, 3 – B. subtilis 10641
Для выполнения данного этапа работы использовали метод агаровых лунок, выбор данного метода объясняется тем, что он позволяет не только визуально, но и качественно оценить влияние тяжелых металлов на рост исследуемых микроорганизмов.
Методика выполнения заключается в следующем: изучаемый микроорганизм высевали сплошным «газоном» на поверхность агаровой пластинки (1,5% МПА) в чашке Петри. После этого, пробочным сверлом (диаметр 5 мм) вырезали агаровые блочки, при этом на одной чашке Петри можно разместить до 7 агаровых лунок в которые в последующем вносили исследуемые концентрации веществ для оценки их ингибирующего и субингибирующего эффекта. Чашки помещали в термостат на 24 часа при температуре 37 °C (благоприятной для развития исследуемого тест-организма). После инкубирования производили визуальную оценку действия исследуемого металла на рост популяции. Отсутствие зон подавления роста свидетельствовало о отсутствии влияния либо соли в целом (как правило данное явление отмечалось у солей с низки уровнем диссоциации), либо определенной концентрации (именно такие концентрации в дальнейшем использовались в качестве рабочих). В том случае если исследуемое вещество обладало высокой активностью в отношении исследуемого микроорганизма регистрировали значительные зоны подавления роста вокруг лунки.
Данные, представленные на рисунке, свидетельствуют о том, что избыточные концентрации катионов цинка не оказывают выраженного бактерицидного эффекта в отношении исследуемых микроорганизмов, однако по мере удаления от лунки наблюдается отсутствие роста популяции бактерии, что в свою очередь свидетельствует о ингибирующем эффекте низких концентраций цинка. Обобщенные данные по изучению влияния катионов цинка на исследуемые микроорганизмы представлены в таблице.
Оценка влияния солей цинка на рост бактерий рода Bacillus
|
B. licheniformis 7048 |
|||||
|
1 Моль |
0,5 Моль |
0,25 Моль |
0,125 Моль |
0,063 Моль |
|
|
ZnSO4 |
33,0±0,00 |
29,7±1,85 |
25,3±1,20 |
24,0±1,53 |
16,0±1,52 |
|
Zn(CH3COO)2 |
33,7±1,86 |
30,0±0,00 |
26,7±1,67 |
23,3±1,67 |
21,0±1,00 |
|
ZnCl2 |
28,3±1,67 |
30,0±0,00 |
25,0±0,00 |
23,3±1,67 |
18,3±1,67 |
|
Zn(NO3)2 |
30,3±1,70 |
28,3±1,33 |
24,3±1,67 |
21,7±1,20 |
15,3±2,03 |
|
B. cereus 5832 |
|||||
|
ZnSO4 |
28,0±1,15 |
22,7±0,88 |
18,7±0,88 |
13,3±1,33 |
8,0±1,06 |
|
Zn(CH3COO)2 |
25,0±0,00 |
17,3±1,20 |
13,0±1,73 |
10,3±0,33 |
6,0±1,00 |
|
ZnCl2 |
24,0±0,58 |
17,3±1,20 |
12,3±1,45 |
8,3±1,67 |
4,0±1,08 |
|
Zn(NO3)2 |
16,0±2,08 |
11,7±1,90 |
8,0±1,00 |
5,7±1,18 |
– |
|
B. subtilis 534 |
|||||
|
ZnSO4 |
30,0±1,33 |
29,0±1,02 |
24,3±2,74 |
22,7±1,88 |
19,7±1,33 |
|
Zn(CH3COO)2 |
34,3±2,33 |
32,3±2,33 |
28,0±1,53 |
25,0±0,00 |
22,3±1,45 |
|
ZnCl2 |
33,0±1,52 |
30,0±0,00 |
28,7±1,33 |
27,0±1,00 |
22,3±1,45 |
|
Zn(NO3)2 |
31,7±1,33 |
29,7±1,83 |
25,0±2,50 |
23,3±1,21 |
19,7±1,88 |
|
B. amyloliquefaciens 10642 |
|||||
|
ZnSO4 |
31,3±1,68 |
27,7±2,94 |
25,7±1,88 |
23,3±0,84 |
20,7±1,36 |
|
Zn(CH3COO)2 |
37,0±1,53 |
36,0±1,00 |
30,0±2,08 |
24,7±2,67 |
21,3±1,33 |
|
ZnCl2 |
32,7±2,67 |
29,3±0,67 |
28,0±0,00 |
25,3±1,36 |
21,3±1,67 |
|
Zn(NO3)2 |
33,0±1,68 |
31,0±1,61 |
26,3±2,21 |
17,0±1,51 |
15,7±0,90 |
|
B. subtilis 10641 |
|||||
|
ZnSO4 |
34,0±1,69 |
33,3±0,56 |
20,3±1,98 |
12,3±1,18 |
1,5±1,33 |
|
Zn(CH3COO)2 |
34,8±0,69 |
31,3±1,33 |
26,0±1,00 |
24,3±1,96 |
19,7±1,33 |
|
ZnCl2 |
25,7±1,85 |
19,7±2,60 |
12,0±0,66 |
10,7±1,33 |
7,4±2,88 |
|
Zn(NO3)2 |
35,0±1,59 |
32,9±0,20 |
30,6±2,06 |
22,3±1,17 |
19,0±2,66 |
|
B. amyloliquefaciens 10643 |
|||||
|
ZnSO4 |
34,7±1,84 |
29,3±2,20 |
21,3±1,75 |
13,3±1,69 |
12,3±1,17 |
|
Zn(CH3COO)2 |
34,0±1,00 |
31,0±2,00 |
29,3±0,67 |
25,6±2,33 |
19,0±1,00 |
|
ZnCl2 |
33,0±1,53 |
30,7±0,66 |
28,3±2,67 |
25,0±0,58 |
22,7±2,85 |
|
Zn(NO3)2 |
33,3±1,67 |
28,0±1,00 |
25,7±1,88 |
21,0±2,54 |
18,6±1,36 |
При исследовании влияния анионных компонентов цинка на пробиотические штаммы были получены следующие результаты. Исследования показывают о достаточно выраженном токсическом влиянии всех исследуемых солей цинка не зависимо от анионного компонента в отношении изучаемых пробиотических штаммов. Но следует отметить, что наиболее выраженным токсическим эффектом в отношении исследуемых микроорганизмов обладает ацетат цинка, однако значения зон подавления роста, которого, незначительно превысили значения сульфата, хлорида и нитрата цинка для изучаемых пробиотических штаммов.
Также было установлено, что в отношении нитрата цинка наиболее устойчивым оказался штамм B. cereus 5832, по отношению к сульфату цинка B. subtilis 10641, к ацетату цинка и к хлориду цинка B. cereus 5832.

