Актуальной на сегодняшний день является разработка, которая дает реальную возможность с помощью незаметного электронного устройства прослеживать состояние организма.
Рассмотрим на примере заболевания – диабета.
Диабет – заболевание эндокринной системы, возникающая в тех случаях, когда поджелудочная железа не вырабатывает достаточно инсулина или, когда организм не может эффективно использовать полученный им инсулин. Инсулин – гормон, который регулирует количество сахара в крови[1]. Пациентам с диабетом рекомендуется ежедневно проверять уровень глюкозы в крови, и периодически делать снимки инсулина для непрерывного контроля анализа крови[2]. Люди с этим заболеванием сталкиваются с множеством неудобств с отслеживанием уровня глюкозы, связанные с проблемой постоянного и удобного способа измерения уровня глюкозы в крови.
Для решения проблемы автоматического контроля глюкозы необходимо использовать датчики, которые способны непрерывно измерять уровень глюкозы 24 часа, даже в то время когда пациент спит. Система должна отображать значение через определенные промежутки времени и выдавать результат, а при превышении порогового уровня глюкозы, сигнализировать об этом пациенту. Кроме того, отчеты тенденции колебаний уровня глюкозы должны иметь возможность быть загружены на компьютер. Система должна быть доступна для любого пациента с диабетом (оба типа 1 и типа 2 больных), а также специалистам в области здравоохранения.
Самый близкий вариант на рынке, на данный момент это Guardian RT.
Согласно проведенным исследованиям работа датчика и переносимость не вызвали никаких проблем, даже с кожей, и без потери контакта или поломки датчик работал. Только один пациент столкнулся с проблемой, потому что не удалось получить адекватную калибровку. Таким образом, 10 парных точек, исходящих от этого пациента, были исключены из анализа исследования. Средний уровень глюкозы в крови составил 154 ± 92 мг/л (8,56 ± 5,11 ммоль/л). Среднее снижение уровня глюкозы в крови 63 ± 63 мг / дл (3,5 ± 3,5 ммоль /л). В целом, 135 парных значений глюкозы были включены в анализ. Коэффициент корреляции между датчиком и уровнем глюкозы в крови составляли 0,957. Средняя абсолютная разница между парными значениями согласно анализу Бланда-Альтмана составляло 10 ± 31 мг /л (0,56 ± 1,72 ммоль / л). Пример работы датчика в сравнении с эталонным анализом (рис. 2). Различие между уровнем глюкозы в крови между оценкой от Guardian RT и контрольной венозной крови (рис. 3) [3].
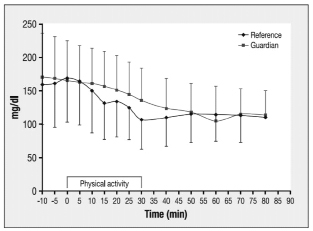
Рис. 1. Уровень глюкозы в крови у девяти пациентов с сахарным диабетом 1 типа непрерывная подкожная инсулиновая инфузия в течение 30 мин при высокой интенсивности нагрузки (На 15% выше индивидуального вентиляционного порога пациентов). Значения глюкозы были оценивали с использованием чувствительной системы Guardian® RT (розовая линия) и измерением глюкозы с использованием эталонного анализа (синяя линия) [3]
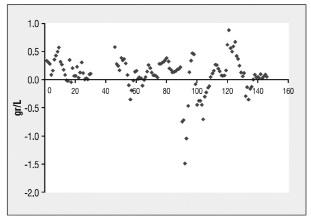
Рис. 2. Различия между уровнем глюкозы в крови оценки с помощью чувствительной системы Guardian® RT и контрольной венозной крови измерения уровня глюкозы у девяти пациентов с диабетом 1 типа [3]
Видно, что, глюкоза снижается во время интенсивных усилий, это можно отслеживать подкожным датчиком, хотя и с тенденцией к более высоким значениям глюкозы в датчике, чем контрольные значения. Такое отставание, видимо, связанно с быстрым затуханием уровня глюкозы в крови. С практической точки зрения, это означает, что пациент может рассмотреть информацию об уровне глюкозы, обеспечиваемую чувствительной системой, но требуется просмотреть абсолютное значение отображаемого уровня глюкозы ради осторожности. Если заданное значение установлено как порог для выключения «гипо», он должен учитывать наличие отставаний и поэтому считаться выше, чем предполагаемый предупреждающий сигнал для «истинных» уровней глюкозы в крови.
Однако это не все проблемы данной разработки, необходимо учитывать основной биологический ответ на имплантированные датчики в месте имплантации: кровь или подкожные ткани. Когда имплантируемый химический датчик находится в контакте с протекающей кровью, исходным биологическим ответом является почти мгновенная адсорбция белков плазмы (например, фибриноген, фибронектин, витронектин и фактор фон Виллебранда (vWF)) на поверхность инородного устройства, что приводит к адгезии, агрегации тромбоцитов, которые захватывают эритроциты и в конечном итоге образует (рис. 3). Такое биологическое обрастание на поверхности имплантируемых датчиков может ограничивать массовый перенос аналитов к чувствительной поверхности, что приводит к ухудшению качества работы датчика. Кроме того, метаболические активности поглощенных клетки, клетки потребляют кислород и глюкозу при производстве диоксида углерода, тем самым изменяя локальную концентрацию этих веществ, что приводит к неточным результатам [4].
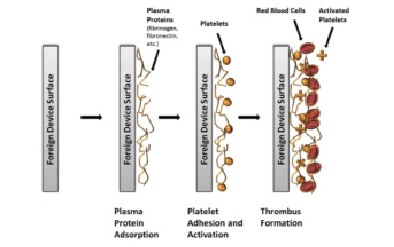
Рис. 1. Последовательный процесс, который в конечном итоге приводит к образованию тромбов на поверхности инородных тел [4]
Будущая интеграция датчиков под кожу сможет помочь с такими болезнями как Паркинсон.
Болезнь Паркинсона является неврологическим прогрессирующим заболеванием ЦНС, которое вызывает расстройство движения, прогрессирующая потеря мышечного контроля (тремор, дрожание рук), что требует четкого планирования принятия лекарств. Медикаментозное лечение позволяет улучшить состояние[5]. В этом случае происходит резкий рост уровня медикаментов в организме и постепенное последующее уменьшение концентрации. Пластырь, что расположен на коже, вводит серию небольших порций медикамента с дальнейшим контролем уровня концентрации. Время введения препарата определяет датчик, отслеживая тремор (дрожание) конечностей.
Так как устройство должно отслеживать тремор в течение долгого времени, при его создании использовался новый формат памяти - резистивная память с произвольным доступом, которая хранит информацию при помощи магнитных моментов, а не электрических зарядов. Новый формат может позволить производить тонкие устройства с низким энергопотреблением, что делает его идеальным для включения в носимую электронику.
Интеграция нового формата хранения данных с инновационной системой доставки лекарственного средства. Нижний слой пластыря покрыт наночастицами кремния, заполненными препаратами. В отличие от никотинового пластыря устройство поставляет лекарства в организм исключительно в случае необходимости. Маленький нагреватель в пластыре автоматически прогревает наночастицы, заставляя их выпускать лекарства в кожу. Датчик температуры предотвращает перегрев устройства и не позволяет ему вызвать ожоги[6].
Текущие разработки в области контроля уровня сахара в крови ещё ведутся, но даже в текущем виде разработки типа Guardian® RT способны существенно упростить жизнь людей с диабетом. Как и любые новейшие подкожные датчики в целом.

