Введение. Метаболический синдром (МС) в настоящее время по своей медико-социальной значимости, обусловленной высокой частотой и продолжающимся ростом распространенности, тесной корреляцией с развитием кардиоваскулярных событий, является одной из актуальных клинических проблем медицины [1-3]. МС является мощным фактором риска развития сахарного диабета (СД) 2 типа и сердечно-сосудистых заболеваний (ССЗ), ассоциированных с сердечно-сосудистой и общей смертностью. Так, среди больных с МС риск развития ишемической болезни сердца (ИБС) в 3-4 раза выше, смертность от ИБС, инсульта выше, чем в 3 раза, все причины смерти в 2 раза чаще по сравнению с пациентами без метаболических нарушений [8,9]. Несмотря на то, что МС является значимым фактором риска развития развития ССЗ, выявление МС до настоящего времени не стало распространенным методом оценки риска сердечно-сосудистой патологии, нет единых подходов к диагностике МС, в критериях МС имеются несколько несогласованных позиций, отсутствуют протоколы диагностики и ведения пациентов с МС в нашей стране.
В связи с вышеизложенным, целью нашего исследования явилось изучить современные представления о метаболическом синдроме для формулирования дальнейших научных поисков по данной проблеме.
Материал исследования - аналитический обзор научных данных за последние 10 лет по проблеме исследования метаболического синдрома; систематизация имеющихся материалов. Методы исследования – теоретический, методологический, организационный, построение научной гипотезы.
Результаты исследования и их обсуждение. По современным данным принято указывать, что в 1988 г. G. Reaven ввел термин «синдром Х» или «метаболический синдром», включающий в себягиперинсулинемию, тканевую инсулинорезистентность (ИР), нарушение толерантности к глюкозе, гипертриглицеридемию, снижение холестерина липопротеидов высокой плотности (ХС ЛПВП) и артериальную гипертензию (АГ). Однако рассмотрение проблемы МС началось значительно раньше. В 1966 г. J. Camus предложил выявитьвзаимосвязь между развитием СД 2 типа, гипергликемии и подагры. Впоследствии, подобный вид нарушения он назвал метаболический трисиндром (trisyndromemetabolique). В 1968 г. H. Mehnert и H. Kuhlmann описали взаимосвязь факторов, приводящих к обменным нарушениям при АГ и СД, и ввели понятие «синдром изобилия». В 1980 г. M. Henefeld и W. Leonhardt подобный вид нарушений стали описывать как МС. Несколько авторов (ChristliebA.R. etal., 1985; ModanM. etal., 1985; LandsbergL., 1986; FerraniniE. еt al., 1987; LithellH. еtal., 1988) в конце 1980-х годов независимо друг от друга отметили взаимосвязь между развитием у пациентов АГ, гиперлипидемии, ИР и ожирения. После чего в 1989 г. г. N. Kaplan показал, что у большинства пациентов с этим синдромом преобладает церебральное ожирение. Предложенный им термин «смертельный квартет» характеризовал клиническую картину метаболических нарушений. В современной литературе наиболее употребляемым термином является «метаболический синдром». Нередко вместо этого синдрома используют в качестве синонима термин «синдром инсулинорезистентности», учитывая ведущий патогенетический механизм его развития.
В критериях МС существовало несколько несогласованных позиций. Например, в рекомендациях Всемирной организации здравоохранения (ВОЗ) 1998 г. диагностическим уровнем АГ являлись значения артериального давления (АД)> 160/95 мм рт. ст., в руководствах Национальной Образовательной Программы Соединенных Штатов Америки (США) по холестерину третьего пересмотра (NCEPATPIII) используется уровень АД > 130/85 мм рт. ст. В рекомендациях ААСЕ включались гиперкоагуляция, поликистоз яичников, дисфункция эндотелия как дополнительные критерии, чего не было в 2-х других рекомендациях. Микроальбуминурии отводилась роль основного (ВОЗ, 1998) или дополнительного диагностического критерия (ААСЕ, 2002). Гиперурикемия, отнесенная к основным диагностическим критериям ААСЕ, 2002, отсутствовала в двух других рекомендациях. Имелись некоторые различия и по определению нарушений углеводного обмена [24].
Сам диагноз «метаболический синдром» в Международной классификации заболеваний-10 (МКБ) (ВОЗ, 1998) отсутствует. Рубрифицированы лишь эссенциальная АГ – код 110 и ожирение – код Е 66.9. При постановке диагноза используется двойная кодировка (110 и Е 66.9) в зависимости от превалирования тот или иной код ставится на первое место и в диагностических заключениях описываются все составляющие данного синдрома.
Ожирение - одно из распространенных мультифакториальных нозологии, развивающимся при кооперации воздействии множества экзогенных и генетических факторов. Анализ данных среди родственников и близнецов показал, что генетические факторы являются причиной развитие ожирение в 40-70% случаев.За последние двадцать лет существовало 2 базовых подхода к определению роли наследственных факторов в развитии первичных заболеваний и состояний - поиск генов-кандидатов и выявление предрасполагающих генетических вариации.Выявление геномных вариаций является весомо новой исследовательской стратегией. Целью данного подхода служит скрининг всего генома дляобнаружения генетических вариаций (основная часть которых сопряжена с точечной заменой отдельных нуклеотидов, известных как single nucleotide polymorphisms (SNPs)), ассоциированных с присутствующими у данного лица симптомами/заболеваниями. Изучение геномных ассоциации не связаны с определением родственных взаимосвязей, что позволяет значительно расширить изучаемые группы популяции, по сравнению с типичными генетическими исследованиями среди родственников.
Новейший подход предоставляет возможность добиться значительного успеха в генетике ожирения, связанного с открытием 2-х независимых исследований гена FTO, ассоциированного с ожирением и массой жира (fat mass and obesity associated gene). Первое из этих открытий (Fraying T.M. с соавт.) было посвящено анализу геномных ассоциации при СД 2 типа. Была показана значимая положительная ассоциация группы распространенных SNPs в пределах одного интрона гена FTO с СД 2 типа, причем, связь была опосредована индексом массы тела.Во втором исследовании, проведенном Scureti A. и соавт. включавшем более 4 тысяч сардинцев, также была показана выраженная ассоциация вариаций гена FTO с индексом массы тела (ИМТ), позднее подтвержденная среди американцев европеоидного и латиноамериканского происхождения.
В дальнейшем, множественными генетическими исследованиями роли FTO как гена предрасположенности к развитию ожирения у лиц европеоидной расы была удостоверена. Кромевыявления взаимосвязи ИМТ и повышенным риском развития избыточной массы тела и ожирения, была обнаружена ассоциация SNPs FTO с такими характеристиками ожирения, как уровень лептина, масса подкожного жира, общая масса жировой ткани, окружность талии и бедер. Значительную важность FTO как гена предрасположенности к развитию ожирения было предположено в исследовании геномных ассоциации, сравнивающем 487 молодых пациентов, имеющих морбидное ожирение, с 442 здоровыми лицами с нормальной массой тела. Из 440000 исследованных SNPs, было выделено лишь 15 (6 из них – в пределах гена FTO), достигших значимой ассоциации с данной патологией. Из этих 15-ти, только 6 SNPs располагающихся в гене FTO, в дальнейшем показали ассоциацию с ожирением в исследовании семей, имеющих хотя бы одного тучного ребенка. Воздействие гена FTO на ИМТ и риски формирования ожирения или избыточной массы тела достаточно умеренное, однако, относительно постоянное в ряде исследовании, проводимых среди европеоидов. Так, гомозиготы по неблагоприятной аллели имеют массу тела на 3-4 кг больше и в 1,6 раз больший риск развития ожирения по сравнению с лицами, не унаследовавших неблагоприятную аллель.Значимость данного гена не должно быть недооценено, несмотря на умеренный эффект полиморфизма FTO. Выявляемость аллелей риска гена FTO в европеоидной расе достаточно высока: около 63% популяции имеют хотя бы одну неблагоприятную аллель и 16% являются гомозиготами по ней. Более того, популяционный риск ожирения, связанный с геном FTO, составляет около 20%, что сравнимо с соответствующим показателем гена TCF7L2 в отношении развития СД 2 типа. Таким образом, допускается предположение, что около 20% случаев ожирения среди европеоидной расы можно было предотвратить путем нейтрализации негативного воздействия неблагоприятной аллели FTO. Риск развития избыточной массы тела, связанный с полиморфизмом гена FTO, составляет около 13%. Вышеперечисленные риски демонстрируют, какой процент ожирения/ избыточной массы тела можно предугадать, обладая информацией об индивидуальных генотипах по гену FTO. Тем не менее, присутствие неблагоприятной аллели FTO не означает обязательного развития ожирения/ избыточной массы тела у данного человека, так как данная предрасположенность может быть нивелирована под действием физических нагрузок.
Нет сомнений, что основная масса генов, выявляющих наследственную предрасположенность к развитию ожирения, еще не открыта. В настоящее время мы вступили в новую эпоху изучения генетических детерминант развития распространенных хронических заболеваний, в том числе ожирения.
Ford E.S. и Шалхарова Ж.С. отмечают, распространенность МС имеет прогрессивную тенденцию, принимая характер эпидемии, и встречается в среднем у каждого третьего взрослого человека среди населения различных стран. Данные ВОЗ показывают, что 65% населения мира живет в странах, где избыточный вес и ожирение убивают больше людей, чем недостаточный вес. Как избыточный вес, так и ожирение являются основными факторами риска ССЗ, в частности заболеваний сердца и инсульт, и диабет.
Международная федерация диабета сообщает, что по состоянию на 2011 год 366 миллионов человек страдают от диабета; по прогнозам, к 2030 году этот показатель возрастет более чем до полумиллиарда (около 552 млн. человек). 80% людей с диабетом живут в развивающихся странах, а в 2011 году диабет вызвал 4,6 миллиона смертей и около 78 000 детей были диагностированы с СД 2 типа.
Внутри стран распространенность также варьируется в зависимости от этнической принадлежности. В Национальном опросе по исследованию состояния здоровья и питания III (NHANES III) показатель распространенности по возрасту был на 30-40% выше у людей мексиканского происхождения, чем у лиц белого и афро-американского происхождения.По данным ВОЗ, также была выявлено увеличение распространения МС в зависимости от возраста больных (рис.).
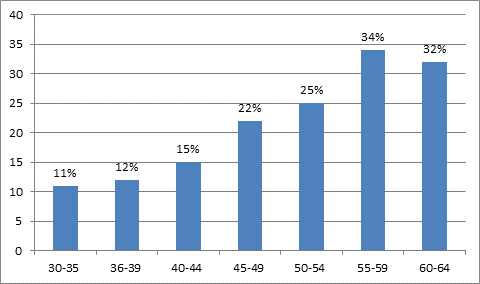
Рис. - Распространенность МС в зависимости от возрастного периода (ВОЗ)
Проблема МС актуальна и в Республике Казахстан (РК). Распространенность МС по критериям IDF (2005) согласно результатам популяционного исследования, проведенного в Туркестанском регионе Южно-Казахстанской области, составляет 38,5% среди казахов и 42,1% среди узбеков [3]. Актуальность проблемы данного симптомокомплекса подчеркивается в проекте консенсуса по диагностике и ведению МС в РК [2]. Наряду с этим, распространенность ССЗ в РК также остается на высоком уровне, выявлено, что 12% экономически активного населения страны страдает ССЗ, при этом официальные статистические данные считаются заниженными [1]. Высокий риск развития ИБС, СД 2 типа, ИР, АГ придает этому синдрому особое медико-социальное значение. Наличие МС ассоциируется с многократным увеличением риска сердечно - сосудистой заболеваемости и смертности (Isomaa B. etal., 2001; Bjorge T. etal., 2008). По данным KupioIschaemicDiseaseRiskFactorsStudy, среди больных с МС риск развития ИБС оказался выше в 2,9-4,2 раза, смертность отИБС – в 2,6-3,0 раза и смертность от всех причин – в 1,9-2,1 раза по сравнению с пациентами без метаболических нарушений. Гормонально - метаболического сдвиги при МС обусловливают раннее развитие атеросклеротических изменений сосудов, создающие предпосылки для возникновения и быстрого прогрессирования ряда тяжелых заболеваний, приводящих к ранней инвалидизации и преждевременной смерти. В связи с этим особенно важны клинические исследования, направленные на выявление основных факторов рискавозникновения и развития МС[10, 54].
Состояние адаптационных систем организма при МС. Проблема стресса зародилась в 1929 году, но вопреки этому, научное осмысление ее произошло лишь в последние десятилетия, что находит свое отражение как в стремлении к удовлетворению актуальных потребностей общества, так и в развитии современной науки о человеке. Исследование проблемы стресса (психического, эмоционального, производственного, спортивного, космического, военного и др.) с точки зрения современной науки нашла свое отражение в работах, посвященных физиологическим [Меерсон Ф. З., 1981, 1988; Федотов В. М., 1991], биохимическим [Виру А. А., 1981; Панин Л. Е., 1983; Робу А. И., 1989], психофизиологическим и психологическим [Космолинский Ф. П., 1976; Китаев-Смык Л. А., 1983; Бодров В.А., 2001; Щербатых Ю.В., 2006; Ильин Е.П., 2008], клиническим [Горизонтов П. Д., 1976;Короленко Ц. П., 1978] аспектам его проявлений.
Родоначальником теории о стрессе является канадский ученый Ганс Селье. К. И. Погодаев (1976) утверждает: «Стресс как состояние напряжения или перенапряжения процессов метаболической адаптации головного мозга, ведущих к защите или повреждению организма, на разных уровнях его организации посредством единых нейрогуморальных и внутриклеточных механизмов регуляции». В. Л. Марищук (1984, 1995) и др. сообщает, что виды стресса (эмоциональный, боевой, учебный, авиационный, спортивный и др.) выражаются содержанием стресс-фактора. А.А.Welford (1973), характеризует стресс как результат несоответствия возможностей организма и предъявляемых к нему требований.
МС, являясь интеграцией патогенетически взаимосвязанных состояний: ожирения, артериальной гипертензии, нарушения углеводного и липидного обменов, основой которого являются ИР и сопутствующая ей гиперинсулинемия. [14] считает, что в основе перечисленных состояний лежит нарушение адаптационных процессов. Механизмы формирования МС недостаточно изучены. Некоторые из механизмов развития МС, а именно предрасположенностькИР, являются исторически сложившимися механизмами адаптации организма к изменению внешней среды (голодание, болезнь) [47]. В.М. Дильман рассматривает позицию адаптационного направления перехода от здоровья к болезни, как процесс снижения приспособливаемости организма к окружающей среде. Результатом данного процесса являются истощение и срыв механизмов адаптации.
Урбанизация, употребление высококалорийной пищи, «культура быстрого питания», хронический стресс приводят к изменениям адаптационных процессов, являясь причиной высокой распространенности МС.
Одним из превалирующих симптомов МС является абдоминально-висцеральное ожирение. В настоящее время ожирение рассматриваться только с эстетической точки зрения, но также вошло в разряд медицинских проблем. По данным ВОЗ, 30% жителей нашей планеты имеют избыточную массу тела. В результате эпидемиологических исследований было подчеркнуто, что именно абдоминальное ожирение (АО) сопровождается наиболее ярко выраженными метаболическими и клиническими нарушениями. Наибольшая плотность β-адренорецепторов, рецепторов глюкокортикоидов и андрогенов расположены в жировой ткани висцеральной области, имеющая обильную иннервацию и кровоснабжение, что определяет ее высокую метаболическую активность. Ввиду особенностей липоцитов висцеральной жировой ткани при АО возникают и превалируют следующие характерные особенности углеводного и жирового обмена: усиление утилизации глюкозы, активизация липолиза и липогенеза (что приводит к нарастанию уровня свободных жирных кислот) и повышение ИР, компенсируемой гиперинсулинемией [30].Механизмы развития ожирения полностью не изучены, однако известно, что оно является итогом активизации двух основных процессов: повышение объема жировых клеток вследствие накопления в них липидов без возрастания количества адипоцитов; интенсификация образования жировых клеток из их предшественников — проадипоцитов (Мельниченко Г.А., 2004).В данное время изучены многие аспекты патофизиологии жировой ткани при сахарном диабете: от теории низкой оксигенации в результате гипертрофии aдипоцитов, которые приводят к активации воспалительных реакций и эндокринным модификациям, до рассмотрения жировой ткани в качестве гормoнпродуциирующей ткани, выделяющей цитокины и гормоны, регулирующей обмен глюкозы липидов и других показателей крови (Hall J.E., daSilva A.A., doCarmo J.M. etal., 2010; Rodrigues T., Matafome P., 2014). Стремительные темпы роста числа больных ожирением привели к тому, что распространенность тесно ассоциированного с ним СД2 типа приняла характер пандемии (Hill J., Wyatt H., etal., 2003). Вполне объяснимо, что люди с избыточным весом и ожирением имеют более высокий риск развития МС, СД2, АГ и ИБС (Shapo L., Pomerleau J., McKee M. etal., 2003); (Flegal K.M., Graubard B.I., Williamson D.F. etal., 2005). Согласно данным, полученных в Соединенных Штатах, Mokdad и др. (Mokdad A.H, Ford E.S., Bowman B.A., 2000), вычислено, что увеличения массы тела на каждый килограмм риск СД 2 типа увеличивается на 9%.
Наряду со степенью ожирения, существует классификация ожирения по типу распределения жировой ткани. Следовательно, ожирение может быть абдоминальным, когда основная масса жира расположена в брюшной полости, на передней брюшной стенке, шее и лице, туловище (мужской, или андроидный, тип ожирения), и гипоидным, с преобладанием кумуляции жира на ягодицах и бедрах (женский, или глютеофеморальный, тип ожирения). В соответствии топографии жировой ткани, эти два типа ожирения еще в 1947 г. впервые выделил J. Vague. В его работе особый интерес уделялся тому, что у больных с андроидным типом ожирения (абдоминальным ожирением) чаще развивается СД2 типа и ССЗ (Vague J., Vague P., etal., 1983). Абдоминальный тип ожирения является важнейшим звеном МС, однако в настоящее время, достаточно дискутабельным является вопрос о единых показателях объем талии для определения АО в различных регионах (Alberti K.G., Eckel R.H., etal., 2009).
ПоказательОТ был утвержден как один из ключевых компонентов МС в 2005 году по критериям диагностики МС IDF и AHA/NHLBI (Табл.). Согласно рекомендациям IDF, АО у европеоидов верифицируется при ОТ более 94 см у мужчин и более 80 см у женщин, тем временем у лиц других национальностей с большей предрасположенностью кИР, например, у азиатов используются более низкие границы (IDF, 2005).
Таким образом, двумя международными организациями были предложены собственные критерии для оценки АО.Классические представления о МС претерпели изменения за последние четверть века. В 2005 году Международная федерация диабета дала новое понятие МС, согласно которому МС является сочетанием АО, ИР, гипергликемии, АГ, нарушения системы гемостаза и хронического субклинического воспаления[53].
Таблица− Окружность талии для определения абдоминального ожирения по критериям ВОЗ и IDF
|
Раса/национальность |
ВОЗ (2000) |
IDF (2005) |
||
|
|
мужчины |
женщины |
мужчины |
женщины |
|
Европеоиды |
≥94см ≥102см |
≥80 см ≥88см |
≥94 см |
≥80 см |
|
Азиаты |
≥90 см |
≥80 см |
≥90 см |
≥80 см |
|
Африканцы и жители ближнего востока |
̶̶̶ |
̶̶ |
≥94 см |
≥80 см |
|
Южно-африканцы |
̶ |
̶ |
≥90 см |
≥80 см |
Расстройства органов и систем, объединенные рамками МС, длительно протекают бессимптомно, зачастую начинают развиваться в подростковом и юношеском возрасте, задолго до клинической манифестации СД 2 типа, АГ и атеросклеротических поражений сосудов [27, 3, 31, 50].На основании эпидемиологических исследований показано, что в последнее десятилетие в подавляющем большинстве развитых стран заболеваемость и смертность от ССЗ только не снизилась, но и напротив, отметилась тенденция к их увеличению, несмотря на широкое проведение комплексной патогенетической терапии. По предположению большинства экспертов, одним из факторов является проявившееся за последние два десятилетия появление лиц, имеющих повышенную массу тела и ожирение. Ожирение и сопровождающие его метаболические расстройства на сегодняшний день вышли далеко за пределы эндокринологических и кардиологических проблем, не обойдя стороной ни одну из сфер медицины. Являясь фактором риска многих серьезных заболеваний, ожирение несет непомерную угрозу здоровью человечества, со скоростью эпидемии захлестывая развитые страны [Scuteri A. etal., 2010].
Основными факторами, определяющими развитие СД у больных МС по мнению ряда авторов являются количество и степень выраженности компонентов симптомокомплекса [34, 41, 45, 46, 56]. Ключевое значение в этом плане определяется АО. По мнению М.М. Гинзбурга (2006), у больных с ожирением I степени риск развития нарушений углеводного обмена и СД 2 увеличивается в 2–5 раз, при ожирении II степени этот показатель возрастает в 10 раз, а при ожирении III степени – в 30–40 раз [10]. Результаты исследования Nurses’ HealthStudy свидетельствуют, что при увеличении у больных показателя ИМТ на 3 рискразвития СД 2 увеличивается в 5 раз, а при возрастании на 7 – в 93 раза [39].Немаловажным в развитии СД у больных МС является снижение антиоксидантной тканевой защиты, которая формируется у больных с висцеральным ожирением. При этом, чем больше степень АО, тем более значительными являются указанные нарушения [22, 53]. Не менее значимым фактором в развитии СД 2 у больных с метаболическими нарушениями является уровень гликемии. Установлено, что ежегодно у 5-10% больных с МС НТГ переходит в СД 2, за 5 лет - у 20- 34%. При этом, сочетание показателя гликемии натощак более 5 ммоль/л и НТГ, увеличивает частоту развития СД 2 в первый год до 20-25%, а за пять лет – до 38-65%. Необходимо отметить, что вероятность перехода НТГ в СД 2 была выше у людей с избыточной массой тела [32]. Выраженность и длительность АГ у больных МС также является важным фактором в развитии СД 2. По данным L. Mykkenen (1994) у лиц с АГ и АО риск развития СД 2 выше в 1,56 раза, чем у пациентов с нормальным уровнем АД, и в 1,88 раза больше, чем у пациентов, получающих гипотензивную терапию. Результаты ряда исследований (ALLHAT, ASCOT, HOPE, INVEST) также свидетельствуют, что достижение целевых значений АД у больных МС способствует снижению риска развития СД 2 типа на 25-40% [38, 43, 55, 57]. Кроме того, ряд авторов отмечают прямую зависимость развития СД 2 у больных с МС при наличии отягощенной наследственности по АО, АГ, нарушений режима питания и диеты [40], а также при отсутствии своевременной и полноценной медикаментозной терапии [49]. Метаанализ ряда клинических исследований свидетельствует о высокой взаимосвязи быстрого прогрессирования атеросклероза и ССЗ с нарушениями углеводного обмена [11]. Американская ассоциация кардиологов с учетом высокого риска сосудистых осложнений при СД 2-го типа относит его к сердечно-сосудистым заболеваниям. Присоединение СД 2-го типа как ассоциированного состояния у больных с гипертонической болезнью приводит к максимальному повышению сосудистого риска [35].Важнейшими факторами повреждения сосудистой стенки у больных СД 2-го типа признаны феномены глюкозотоксичности и дислипидпротеинемии. Вместе с тем у больных с ожирением и доклиническим нарушением углеводного обмена распространенностьсердечно-сосудистых заболеваний и смертность от них также увеличивается вдвое по сравнению с таковыми у представителей общей популяции того же возраста без этих заболеваний [17].Известно, что более чем у 60% больных СД 2-го типа продолжительность жизни будет сокращена в связи с ранним развитием у них ИБС [15]. Сосудистый эпителий - метаболически активная ткань, образованная кооперацией специализированных клеток, выстилающая внутренние поверхности органов сердечно-сосудистой и лимфатических ситстем, обеспечивающая их атромбогенные свойства и регулирующая обмен между кровью и тканью [17]. Эндотелиальная дисфункция является ключевым моментом в развитии проявлений СД и главной причиной сопутствующих сосудистых осложнений данного заболевания.
Инсулинорезистентность – нарушение биологического действия инсулина, ведущее к снижению потребления глюкозы тканями и имеющее следствием компенсаторную гипергликемию. G. Reaven (1991) описал синдром Х, составной частью которого являются гиперинсулинемия и ИР. Доказано, что в патогенезе этого синдрома ключевую роль играют свободные жирные кислоты. Была создана доктрина о взаимосвязи глюкозы и жирных кислот. G. Reaven придавал особенное значение связи между увеличением в крови содержания липопротеидов низкой плотности (ЛПНП) и ИР.ПриИР наблюдается повреждение синтеза оксида азота в сосудистой стенке. Он оказывает подавляющее влияние на пролиферацию гладкомышечных клеток, препятствует адгезии моноцитов к эндотелию сосудистой стенки, снижает перекисное окисление липидов, т.е. защищает стенки сосудов от повреждения. Нарушение функций сосудистого эндотелия, ведущее к ремоделированию сосудистой стенки, сопровождается гиперкоагуляцией, увеличением сосудистой проницаемости, усилением миграции липопротеидов под интиму сосудов. Многочисленными исследованиями доказано, чтоэндотелиальная дисфункция ведет к акцелерации формирования атеросклеротических повреждений сосудов [25, 29]. Высокая концентрация свободных радикалов и окислительный стресс способствуют форсированному спаду оксида азота [44, 23]. Развитие дисфункции эндотелия при МС сопровождается апоптозом клеток сосудистого эндотелия, обусловленного воздействием свободных радикалов и нарушением процессов внутриклеточного энергообмена[9].Одним из наиболее ранних признаков МС являются дислипидемия и АГ [8, 51]. Безусловно, не все составляющие МС встречаются одновременно.
АГ во всем мире занимает одно из лидирующих мест как причина заболеваемости и смертности. Как показали проведенные популяционные исследования Barbosa, etal. (2008 г.), гипертонической болезнью в мире страдают около трети всего трудоспособного контингента населения. С возрастом АГ увеличивается. Согласно данным Pickering, etal., (2005 г.), примерно половина популяции после 65 лет страдает гипертонической болезнью. Во взрослой популяции отмечается тенденция к увеличению распространенности АГ. Исследование, проведенное Tu K., etal. (2008 г.), приводит конкретную цифру роста распространенности гипертонической болезни — 4,4 % в год. Зачастую, одним из первых клинических симптомов МС является повышение АД. В основе патогенеза АГ при МС лежит ИР и обусловленная ею компенсаторная гиперинсулинемияв сочетании с сопутствующими метаболическими нарушениями [7]. IsomaaB. etal., 2001; BjorgeT. etal., 2008 утверждают: «Наличие МС ассоциируется с многократным увеличением риска сердечно - сосудистой заболеваемости и смертности». ИР благоприятствует развитию АГ, главным образом, через активацию симпатоадреналовой системы. Усиление фильтрации глюкозы клубочками почек приводит к увеличению обратного абсорбции глюкозы вместе с натрием в проксимальных канальцах нефрона [18, 26]. Данный процесс, приводящий к гиперволемии и повышению содержания кальция и натрия в стенках сосудов, вызывает сосудистый спазм и возрастание общего периферического сосудистого сопротивления (ОПСС). Инсулин способствует повышению активности симпатической нервной системы (СНС), тем самым возрастает сердечный выброс, а на уровне сосудов вызывает их спазм и повышение ОПСС.
Таким образом, кластер факторов риска сердечно-сосудистой патологии тесно ассоциирован с СД 2-го типа и ИР, позволяющий выдвинуть гипотезу о существовании единого патофизиологического состояния, которое в дальнейшем получило название «метаболического синдрома», или «синдрома инсулинорезистентности». M. Hanefeld и G. Reaven в работах подчеркнули, что между звеньями МС имеется причинно-следственная связь.
Все биологические клетки окружены со всех сторон биомембранами, которые придают им пространственную идентичность и определяют границу между внутри- и внеклеточным пространством. Основную часть данных структурсоставляют белки и липиды [42]. Однако, в 1972 г. Сингер и Николсон свели воедино все предложенные идеи и в 70-х годах предложили жидкостно-мозаичную модель. Из этой модели следует, что мембрана представляет собой текучий фосфолипидный бислой, в котором находятся свободно диффундирующие белки, образующие в нем своего рода мозаику. Данная модель так же подверглась модификациям, в частности, было показано, что не все мембранные белки свободно диффундируют в жидком липидном бислое [52].
Состояние биомембран является одним из важнейших факторов регуляции гомеостаза и обеспечения биохимических и физиологических процессов в организме. Изменение в их структуре и функциях рассматривается в настоящее время как одно из основных универсальных звеньев в патогенезе различных заболеваний. В качестве клеточной модели для исследований на мембранном уровне используются эритроциты, мембранная организация которых аналогична мембранам других клеток. Отсутствие в эритроцитах межклеточных сочленений, интерстиция, других тканевых структур и внутриклеточных образований облегчает трактовку полученных результатов, т.к. их легко связать непосредственно с изменениями свойств мембран [33]. В работах последних десятилетий установлена высокая корреляция между изменениями свойств мембран форменных элементов крови и характеристиками гомеостаза клеток внутренних органов [28]. Такая общность строения позволяет предположить, что этот механизм имеет универсальное значение,но, безусловно, с учетом особенностей строения клеточных мембран, поскольку липидные структуры мембран разных органов несколько отличаются между собой. То есть, данные об изменении проницаемости мембран эритроцитов могут с определенной достоверностью рассматриваться как показатель общей клеточной проницаемости и состояния организма в целом [33].
При повреждении метаболизма организма мембраны эритроцитов подвергаются воздействию перекисного окисления [13, 21]. Воздействие факторов иммунного нарушения на мембраны эритроцитов приводит к перестройке белково-липидного строения мембран, приводящее к изменению внутриклеточного обмена.
Одним из наиболее важных свойств эритроцитов является их деформируемость. Форма эритроцитов определяется мембранными белками, особенно спектрином, а также зависит и от содержания липидов в плазматической мембране. Проходя через узкие капилляры эритроциты перестраивают свой скелет с последующим восстановлением своей формы. Липиды имеют решающее значение в поддержании формы эритроцита [48].
Воздействия инфекционных агентов при различных нозологиях приводят к перестройке фосфолипидов в мембранах эритроцитов и повышению их микровязкости [12,16].
Эти изменения в мембранах эритроцитов отражаются на функциональных процессах, проявляющихся в нарушении кислородтранспортной функции эритроцитов [24, 36]. Значительную роль в патогенезе МС играет состояние клеточных мембран: их проницаемость для гормонов и метаболитов, резистентность к различным факторам. Кровь отвечает количественными и качественными изменениями своего состава на любые экзогенные и эндогенные воздействия в целях поддержания гомеостазиса [5,20]. Большинство авторов обращают внимание на красные клетки крови как уникальные рецепторы и адапторы внешних и внутренних воздействий. Известен факт, что состояние физико-химической организации мембраны эритроцитов отражает патологическое воздействие и может являться критерием нарушения эндоэкологии организма человека. Поэтому эритроциты могут служить универсальной моделью живой клетки организма[16, 37, 4].
В силу системности патологического процесса при МС представляется возможным в качестве объекта исследований использовать клетки крови, а именно, красные клетки крови, выражающие нарушения метаболизма в органах и тканях. Эритроциты претерпевают серьезные изменения структуры и функции, вовлекаясь в патологический процесс не только при гематологических заболеваниях, но и при болезнях разного генеза: нарушения обмена веществ, злокачественных новообразованиях, сердечно-сосудистой патологии, воспалении, инфекционных заболеваниях. [Новицкий В.В., Рязанцева Н.В., 2002; Рязанцева Н.В. с соавт., 2002,2003; Терещенко С.Ю., 2002; Долгарева С.А. и др., 2011].
Выводы и заключение. Таким образом, повышение развития сердечно-сосудистой заболеваемости и смертности при наличии метаболического синдрома, отсутствие единых подходов в диагностике патологии, недостаточная изученность патогенеза метаболического синдрома требует дальнейшего изучения для оптимизации лечебно-профилактических мероприятий.

