Методами дифференциально-термического анализа (ДТА) и ренгенофазового анализа (РФА) изучено взаимодействие компонентов в системе BiCl3 – AgCl. Установлено, что компоненты BiCl3 и AgCl кристаллизуются из жидкости по хорошо известной эвтектической схеме, и при 100оС из кристаллов BiCl3 и AgCl образуется химическое соединение по схеме BiCl3 + AgCl = AgBiCl4. Изучение системы BiCl3 – AgCl представляет интерес в связи с тем, что в системах на основе галогенидов висмута (III) обнаружены соединения с высокой ионной проводимостью в твердом состоянии [1-2]. Взаимодействия хлорида висмута(III) с хлоридом серебра изучено недостаточно [3].
Нами исследована система BiCl3 – AgCl методами дифференциального термического и рентгенофазового анализа, кроме того, определены некоторые физико-химические константы соединения AgBiCl4. Плавкость системы изучали двумя методами: на пирометре – с записью дифференциальных кривых время – температура и визуально – политермическим методом [4].
Необходимые для работы хлористые соли висмута и серебра получали хлорированием соответствующих металлов газообразным хлором. Хранение, взвешивание и пересыпание хлоридов производили в условиях, исключавших соприкосновение их с влагой воздуха. Температура плавления хлоридов висмута и серебра соответственно составляло 230о и 455оС.
По результатам ДТА построена Т – Х фазовая диаграмма системы BiCl3 – AgCl, представленная на рисунке. В системе при концентрации 50 мол. % AgCl и температуре 100оС, лежащей ниже эвтектической температуры (168оС), из кристаллов BiCl3 и AgCl образуется химическое соединение: BiCl3 + AgCl = AgBiCl4.
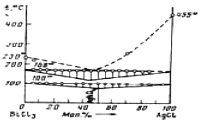
Рис.1. Диаграмма состояния системы BiCl3 – AgCl

Рис.2. Штрихрентгенограммы образцов системы BiCl3 – AgCl, содержащих BiCl3 (мол. %): а – 100, б – 65, в – 50, г – 35, д – 25, е – 0
Образование AgBiCl4 происходит при понижении температуры и сопровождается выделением тепла. На кривых охлаждения сплавов системы, кроме изломов, отвечающих температурам начала кристаллизации BiCl3 или AgCl, и эвтектических остановок, наблюдаются горизонтальные участки при 100оС, отвечающие нонвариантному равновесию. Ликвидус диаграммы изучали не полностью ввиду разрыва реакционных сосудов Степанова, поэтому на рис. 1 он представлен пунктиром. Данные РФА подтверждают образование новой фазы – AgBiCl4 (рис. 2). Плотность фазы AgBiCl4 измерена пикнометрического методом и равна 4,60 г/см3.

