Пероксид водорода H2O2 – бесцветная, прозрачная жидкость, является одним из важных побочных продуктов метаболизма и проявляет окислительно-восстановительный дуализм с преобладанием окислительных свойств. В чистом виде H2O2 термодинамически нестабилен, чем обусловлено его экзотермическое разложение с образованием воды и кислорода: 2H2O2 → 2H2O + O2↑; DH0 = –188,55 кДж. Разложение H2O2 ускоряется на свету, а также в присутствии ионов d-элементов с незавершенным d-подуровнем. Более устойчивы водные растворы пероксида водорода, способные сохраняться длительное время в прохладном темном месте.
В митохондриях атомы водорода, отщепленные от субстрата дегидрогеназами, передают свои электроны через цепь переносчиков кислороду, который восстанавливается до воды: 4H++ O2 + 4e- → 2H2O. При этом физиологически важно, чтобы присоединив 4 электрона, молекула O2 восстанавливалась до двух молекул воды, поскольку при неполном восстановлении O2, например, при присоединении 2-х электронов образуется H2O2: 2H+ + O2 + 2e- → H2O2, а при присоединении 1 электрона – гипероксидный (надпероксидный) радикал: O2? + e-→ O2-. Известно, что пероксид водорода и гипероксидный радикал O2- токсичны для клеток, т.к. взаимодействуя с липидами клеточных мембран, повреждают их. Аэробные клетки при помощи фермента каталазы и медьсодержащего фермента супероксиддисмутазы (СОД) могут защитить себя от указанного вредного воздействия, превращая H2O2 и O2- в кислород, который участвует в последующих процессах биологического окисления.
2O2- + 2H+ 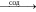 2O- + 2H+
2O- + 2H+ 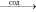 H2O2 + O2;
H2O2 + O2;
2H2O2  2H2O + O2.
2H2O + O2.
В качестве фармакопейного препарата применяют 3 %-ный водный раствор пероксида водорода. В медицине препараты пероксида водорода используются наружно как бактерицидное и дезодорирующее средство для обработки ран, полосканий полости рта и горла.
Таким образом, пероксид водорода имеет важную медико-биологическую роль.

