Коллоидно-мицеллярные растворы ПАВ являются термодинамически устойчивыми и равновесными системами, поэтому для их описания может быть использован термодинамический метод.
Исходя из псевдофазной модели [1], которая наиболее обоснована экспериментально и, считая мицеллу фазой чистого ПАВ, а критическую концентрацию мицеллообразования (ККМ) как концентрацию насыщения молекулярно-дисперсных частиц, для разбавленных водных растворов ПАВ можно получить выражение
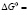 RTlnCk (1)
RTlnCk (1)
где 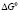 – изменение стандартной энергии Гиббса; R – универсальная газовая постоянная; T – абсолютная температура раствора; Ck – критическая концентрация мицеллообразования (ККМ).
– изменение стандартной энергии Гиббса; R – универсальная газовая постоянная; T – абсолютная температура раствора; Ck – критическая концентрация мицеллообразования (ККМ).
Энтальпию мицеллообразования 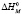 можно определить из температурной зависимости ККМ в соответствии с уравнением Вант-Гоффа, допуская независимость размера мицелл от температуры
можно определить из температурной зависимости ККМ в соответствии с уравнением Вант-Гоффа, допуская независимость размера мицелл от температуры
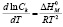 (2)
(2)
Полагая в (2) 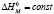 и выполняя интегрирование, получим
и выполняя интегрирование, получим
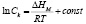 (3)
(3)
Изменение энтропии при мицеллообразовании можно рассчитать, пользуясь выражением
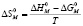 (4)
(4)
Расчеты стандартных термодинамических потенциалов мицеллообразования на основании экспериментальных определений величин Ck и T с использованием соотношений (1), (3) и (4) позволяют оценить энергетику процесса мицеллообразования и взаимодействия молекул ПАВ с растворителем.
В данной работе исследовали релеевское рассеяние света (РРС) в водных растворах ПАВ. Для исследования процессов мицеллообразования в водных растворах были выбраны неионогенные ПАВ с общей формулой
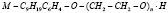 (АФ9 – ne)
(АФ9 – ne)
Эти ПАВ представляют собой оксиэтилированые производные М – изононилфенола с различной степенью оксиэтилирования 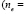 4,6,10,12 и содержат ~ 98% активного вещества, в основном соответствующего общей формуле [2, 3].
4,6,10,12 и содержат ~ 98% активного вещества, в основном соответствующего общей формуле [2, 3].
Результаты расчета термодинамических параметров процесса мицеллообразования в водных растворах ПАВ представлены в таблице 1.
Таблица 1
Результаты расчета термодинамических параметров процесса мицеллообразования в водных растворах ПАВ
|
|
T,K |
|
|
|
|
|
4 |
293 313 333 353 |
23,3 24,9 26,5 28,0 |
0,40 |
23,7 25,3 26,9 28,4 |
80,9 80,8 80,8 80,5 |
|
6 |
293 313 333 353 |
24,4 26,2 27,9 29,6 |
0,83 |
25,2 27,0 28,7 30,4 |
86,0 86,3 86,2 86,1 |
|
10 |
293 313 333 |
17,1 18,3 19,5 |
1,04 |
18,1 19,3 20,5 |
61,9 61,8 61,7 |
|
12 |
293 313 333 353 |
16,5 17,8 19,3 20,6 |
3,52 |
20,0 21,3 22,8 24,1 |
68,3 68,1 68,5 68,3 |
При расчете термодинамических параметров использовали соотношения (1), (3) и (4). Изменение стандартного потенциала Гиббса 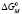 при переходе молекул ПАВ в мицеллярное состояние (в расчете на 1 моль) определялось с помощью выражения (1). Величину энтальпии мицеллообразования находили по тангенсу угла наклона прямой, которая выражает зависимость lnCk от
при переходе молекул ПАВ в мицеллярное состояние (в расчете на 1 моль) определялось с помощью выражения (1). Величину энтальпии мицеллообразования находили по тангенсу угла наклона прямой, которая выражает зависимость lnCk от 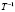 (см. уравнение (3)). Изменение энтропии процесса мицеллообразования рассчитывали по формуле (4).
(см. уравнение (3)). Изменение энтропии процесса мицеллообразования рассчитывали по формуле (4).
Как видно из таблицы 1 энтальпия мицеллообразования ПАВ (АФ9 – 4, АФ9 – 6, АФ9 – 10, АФ9 – 12) в воде положительна, т.е. процесс агрегации молекул в мицеллы идет с поглощением тепла. Изменение энтропии также положительно, но при этом энтропийное слагаемое 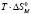 по абсолютной величине превышает изменение энтальпии, что обеспечивает во всех случаях, в соответствии с уравнением (4), отрицательное значение изменения термодинамического потенциала Гиббса в процессе мицеллообразования. Таким образом, решающую роль в протекании самопроизвольной ассоциации молекул исследованных ПАВ в воде играет энтропийный вклад в изменение потенциала Гиббса. Это обусловлено уменьшением структурированности воды в результате уменьшения термодинамически невыгодных контактов углеводородных радикалов с водой и уменьшением гидратации полярных групп.
по абсолютной величине превышает изменение энтальпии, что обеспечивает во всех случаях, в соответствии с уравнением (4), отрицательное значение изменения термодинамического потенциала Гиббса в процессе мицеллообразования. Таким образом, решающую роль в протекании самопроизвольной ассоциации молекул исследованных ПАВ в воде играет энтропийный вклад в изменение потенциала Гиббса. Это обусловлено уменьшением структурированности воды в результате уменьшения термодинамически невыгодных контактов углеводородных радикалов с водой и уменьшением гидратации полярных групп.


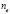
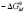 , кДж/моль
, кДж/моль
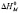 , кДж/моль
, кДж/моль
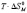 , кДж/моль
, кДж/моль
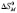 , Дж/(моль·К)
, Дж/(моль·К)