Как ранее было показано, феноксициклопропан в условиях нитрозирования трансформируется в гетероциклическую систему изоксазолинового ряда [1]. С целью изучения конкурирующего влияния малого цикла и заместителей в феноксипроизводных мы изучили взаимодействие феноксиаллила (1) с азотистой кислотой, образующейся in situ.
В нашем случае наблюдалось образование p-нитрофеноксиаллила (2), а также p-нитрозофено-ксиаллила (5) и продукта перегруппировки Кляйзена - о-аллилфенола (3) [2]
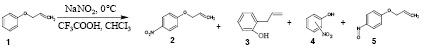
Рис. 1. Взаимодействие феноксиаллила с азотистой кислотой, образующейся in situ
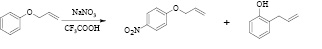
Рис. 2. Реакция феноксиаллила с системой NaNO3-CF3COOH
Превращение нитрозосоединений в нитросоединения под действием кислорода воздуха известный факт [3]. Однако образование минорных количеств нитросоединений в нашем случае является результатом параллельной реакции, что косвенно подтверждается при реакции (1) с системой NaNO3 – CF3COOH.
Реакционная смесь в данном случае имела желтую окраску, что свидетельствует об отсутствии значимых количеств нитрозосоединений. Реакция протекает с преимущественным образованием пара-нитропроизводного (2), и образованием пара-нитрозопроизводного лишь в качестве побочного продукта. Был выделен также о-аллилфенол.
Экспериментальная часть
Спектры ЯМР 1Н и 13C регистрировали на спектрометре «Varian BXR-400» в CDCl3. В качестве внутреннего стандарта использовали остаточный сигнал CHCl3 (δ 7.25, м.д). ИК спектры записывали на спектрофотометре UR-20 в интервале 400-3600 см-1 в вазелиновом масле. Масс-спектры получали на приборе Finnigan SSQ 7000 (типа GC-MS) с использованием капиллярной колонки (30 м х 2 мм, неподвижная фаза DВ-1), газ-носитель – гелий (40 мл/мин) и программированием температуры от 50 до 300°С (10 град/мин). Энергия ионизации 70 эВ. Разделение реакционных смесей и контроль чистоты продуктов реакции проводили на колонках и на пластинах в тонком слое, носитель – силикагель L40/100 мкм (Чехия), используя элюент – диэтиловый эфир-петролейный эфир (40-70°С), 1:3 (по объему).
Взаимодействие соединения (1) с системой NaNO2 – CF3COOH. К раствору 10 ммоль соединения (1) в 5 мл CF3COOH и 10 мл CHCl3 прибавляли 10 ммоль NaNO2 при температуре 0оС в течение 30 мин. Смесь перемешивали 30 мин, разбавляли 300 мл воды, экстрагировали 50 мл CHCl3. Органический слой промывали водой до достижения нейтральной среды и сушили MgSO4. Растворитель отгоняли, остаток хроматографиировали на силикагеле.
В результате реакции из феноксиаллила (1) образуется 3-(4-нитрозофенилокси)-1-пропен (5), жидкость синего цвета. Спектр ЯМР 1Н (CDCI3), δ, м.д.: 4.68 д (2H, СН2, 3J 5.3 Гц), 5.45 д (1H, СН2, 3J 10.4 Гц), 5.60 д (1H, СН2, 3J 17.2 Гц), 6.23 д.д.т (1H, СН2, 3J 5.3, 3J 10.4, 3J 17.2 Гц), 7.05 д (2Hаром, J 9.0 Гц), 7.92 д (2Hаром, J 9.0 Гц). Спектр ЯМР 13C (CDCI3), δ, м.д.: 69.41, 114.55, 118.74, 124.63, 131.8, 163.93, 164.62. Масс-спектр, m/z (Iотн, %): [M]+ 163 (78), 122 (19), 108 (6), 93 (16), 65 (11), 63 (15), 41 (100). Найдено, %: С 66.56; Н 5.73; N 8.44. С9Н9NO2. Вычислено, %: С 66.25; Н 5.56; N 8.58. В ходе реакции был выделен 3-(4-нитрофенилокси)-1-пропен (2), т.кип. 126-129оС (3 мм рт.ст.). Спектр ЯМР 1Н (CDCI3), δ, м.д.: 4.68 (2H, СН2, 3J 5.3 Гц), 5.45 д (1H, СН2, 3J 10.4 Гц), 5.60 д (1H, СН2, 3J 17.2 Гц), 6.23 д.д.т (1H, СН2, 3J 5.3, 3J 10.4, 3J 17.2 Гц), 7.05 д (2Hаром, J 9.0 Гц), 7.92 д (2Hаром, J 9.0 Гц); а также 2-аллилфенол (3) и нитрозамещенные фенолы.

