I. Общие сведения
Саркома Юинга (лат. myeloma endotheliale) — злокачественная опухоль костного скелета. Саркома Юинга, как правило, поражает нижнюю часть длинных трубчатых костей, ребра, таз, лопатку, позвоночник и ключицу.
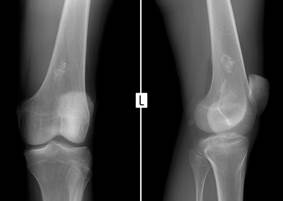
Была открыта Джеймсом Юингом в 1921 году. Учёный охарактеризовал её как опухоль, поражающую в основном длинные трубчатые кости.
Саркома Юинга является одной из самых агрессивных злокачественных опухолей. До применения системной терапии почти у 90 % больных развивались метастазы. Наиболее частая локализация метастазов на момент первичной диагностики — лёгкие, кости, костный мозг. 14—50 % пациентов к моменту установления диагноза уже имеют метастазы, выявляемые рутинными методами исследования, и гораздо больше больных имеют микрометастазы.
Саркома Юинга является второй по частоте среди злокачественных опухолей костей у детей — составляет 10-15 %. Эта опухоль редко встречается у детей моложе 5 лет и у взрослых старше 30 лет. Пик заболеваемости приходится на 10 −15 лет.
II. Причины возникновения, клиническая картина
К настоящему времени не удалось выявить потенциальные причины возникновения саркомы Юинга. Существует ряд научных данных, свидетельствующих о роли наследственного компонента в механизме развития заболевания. В частности, описано одновременное развитие саркомы у сиблингов, что позволяет судить о значении генетических дефектов. Также доказано, что в 40 % случаях возникновение костной саркомы провоцирует травма.
Саркома Юинга состоит из мелких круглых клеток со скудной цитоплазмой, круглым ядром, содержащим нежный хроматин и слабо просматривающиеся базофильные нуклеолы. В отличие от остеосаркомы, она не продуцирует остеоид.
Идея эндотелиальной природы опухоли Юинга превалировала до 1980 года. Исследования, проведенные в последние годы, показали нейрогенную природу опухоли Юинга. Чаще саркома Юинга является недифференцированной опухолью костей. В специальной литературе появился термин «семейство опухолей типа саркомы Юинга». К нему относят: собственно саркома Юинга; периферические примитивные нейроэктодермальные опухоли (PNET), в том числе PNET костей, и экстраоссальная саркома Юинга.
Клиническая картина
Общие симптомы:
- Боль (от момента появления первых болевых ощущений до установления диагноза проходит от 6 до 12 месяцев)
- Первоначально:
- слабая и умеренной интенсивности
- интермиттирующий характер — может самопроизвольно ослабевать и даже полностью купироваться (т.н. «светлые промежутки»)
- не стихает в покое
- усиление по ночам
- отсутствует облегчение при фиксации конечности.
- По мере роста опухоли боль:
- становится интенсивнее
- ограничивает движения в близлежащем суставе вплоть до контрактуры
- нарушает сон
- нарушает повседневную активность
- Быстроувеличивающаяся опухоль нередко с патологическим переломом (поздний признак — 3-4 мес)
- Признаки местного воспаления:
- болезненность при пальпации
- гиперемия кожи
- пастозность (отечность) кожи
- локальное повышение температуры
- расширенные подкожные вены
- Синдром общей опухолевой интоксикации
- повышение температуры тела больного (субфебрильная и фебрильная лихорадка)
- снижение веса и аппетита вплоть до кахексии
- слабость
- анемия
- регионарный лимфаденит
- Метастазы
- в лёгочную ткань (чаще всего)
- в костную ткань
- в костный мозг
- отдаленные метастазы (очень редко): в висцеральных органах, лимфатических узлах средостения и забрюшинного пространства, плевре, центральной нервной системе в виде поражения менингеальных оболочек и вещества головного и спинного мозга.
III. Диагностика
· Рентгенография костей, пораженных опухолью и её метастазами
· Рентгенография и КТ легких
· КТ или МРТ участков скелета, мягких тканей и любых других анатомических областей, пораженных опухолевым процессом. Наиболее точно определяет размеры опухоли, её связь с окружающими тканями, сосудисто-нервным пучком, распространение опухоли по костно-мозговому каналу.
· Позитронно-эмиссионная томография (ПЭТ)
· Остеосцинтиграфия. Позволяет диагностировать отдаленные метастазы
· Ангиография
· УЗИ
· Биопсия, ПЦР
IV. Современные методы лечения
IV.1 Локализованный опухолевый процесс:
При клинически локализованной форме заболевания к моменту установления диагноза 90% больных имеют микрометастазы, поэтому локальное лечение (операция или лучевая терапия) должно обязательно сопровождаться комбинированной химиотерапией. Комбинация химиотерапии, операции и/или лучевой терапии повысила уровень 5- летней выживаемости с 10% до 60%. После биопсии опухоли и тщательного обследования проводится от 4 до 6 циклов индукционной химиотерапии в течение 12- 24 недель, далее следует локальный метод лечения с последующим назначением от 6 до 10 циклов химиотерапии с 3-х недельным интервалом. Продолжительность лечения составляет 8-12 месяцев. Наиболее активными цитостатиками являются доксорубицин, циклофосфамид, ифосфамид, винкристин, дактиномицин и этопозид. Фактически все режимы лечения основаны на комбинациях из 4-6 перечисленных препаратов. Наиболее эффективные режимы лечения включали, как минимум, один алкилирующий химиопрепарат (ифосфамид или циклофосфамид) и доксорубицин. Добавление ифосфамида и этопозида в программу лечения значительно улучшило результаты терапии у пациентов с неметастатической Саркомой Юинга / ПНЭТ. Радикальная операция в тех случаях, когда она выполнима, расценивается как наилучшая возможность локального контроля. Лучевая терапия показана при невозможности выполнения радикального оперативного вмешательства и обсуждается в тех случаях, когда при гистологическом исследовании удаленного материала определяется недостаточный лечебный патоморфоз (то есть выявляется более 10% жизнеспособных опухолевых клеток). Нерадикальная операция с последующей лучевой терапией не более эффективна, чем только лучевая терапия. Лучевая терапия проводится в дозах 40-45 Гр при микроскопических остаточных опухолях и 50-60 Гр при наличии макроскопических изменений. Основным методом лечения пациентов этой морфологической группы остаётся химиотерапия. Радикальное хирургическое лечение, так же как и лучевая терапия обеспечивают локальный контроль над заболеванием. Выбор объёма хирургического лечения должен быть индивидуализированым и зависеть от расположения первичного очага, его размеров, ответа на проводимую химиотерапию, возраста пациента и предполагаемого прогноза жизни.
IV.2 Хирургическое лечение саркомы Юинга:
В современной практической онкоортопедии развитие химиотерапии, внедрение новых подходов в хирургической технике и проведении анестезиологического пособия, инновационное развитие технологии изготовления эндопротезов, позволило кардинально изменить качество жизни и улучшить выживаемость пациентов, максимально возможно продлить срок службы имплантатов. Вследствие чего в настоящий момент органосохранные операции являются золотым стандартом лечения пациентов с диагнозом саркома кости. В настоящий момент в онкоортопедии выделяют следующие виды оперативного лечения:
1. Калечащие операции (ампутации, экзартикуляции);
2. Органосохранные:
2.1 Не требующие последующий реконструкции дефекта;
2.2 Требующие последующей реконструкции дефекта.
Главным условием операбельности пациентов с диагнозом саркома кости является радикальность и абластичность удаления опухоли, что должно гарантировать отсутствие местного рецидива. Радикальными считается следующие виды оперативного лечения: 1. Ампутация или экзартикуляция конечности. 2. Костные резекции при наличии минимального необходимого отступа от предполагаемого края опухоли не менее 3—5 см (при условии отсутствия распространения опухоли в костномозговом канале оставшейся части кости). 3. Удаление опухоли без вскрытия псевдокапсулы (en Block). В настоящий момент основными показаниями к проведению калечащих операций в объёме ампутации или экзартикуляции являются: 1) Обширное первично-множественное распространение опухоли. 2) Вовлечение в опухолевый процесс на протяжении магистрального сосудистонервного пучка, значительный внекостный компонент опухоли, исключающий проведение реконструктивно-пластического этапа операции. 3) В паллиативных целях, при отрицательном эффекте проводимого консервативного лечения. 4) Отказ пациента от органосохранной операции. 5) Наличие распада опухоли и кровотечения. В остальных случаях в первую очередь следует рассматривать возможность выполнения органосохранных операций. Размер первичного очага опухоли, степень распространения внекостного компонента не могут использоваться, как самостоятельные независимые критерии в решении вопроса о проведении калечащей операции. В современной онкоортопедии среди различных способов восстановления дефекта и функции конечности после удаления опухолевого очага, лидирующие положения занимают высокотехнологические операции с использованием эндопротезов, что позволяет улучшить качество жизни пациентов в короткие сроки после операции на фоне хорошего функционального результата. Выделяют следующие виды реконструктивных операций в объёме эндопротезирования:
1. Стандартные первичные операции у взрослых;
2. Стандартные первичные операции у детей и подростков;
3. Эндопротезирование редких анатомических зон;
4. Ревизионное эндопротезиование.
Требования предъявляемые к конструкции эндопротеза при первичном эндопротезировании у взрослых:
1. Модульность конструкции эндопротеза.
2. Максимальная надёжность и ремонтопрегодность эндопротеза;
3. Универсальность компонентов эндопротеза;
4. Максимальный срок службы;
5. Стабильная фиксация эндопротеза;
6. Хороший функциональный результат;
7. Короткий срок изготовления эндопротеза.
Вышеперечисленные характеристики эндопротеза дают возможность при замещении различных сегментов костей и суставов отказаться от необходимости индивидуального заблаговременного изготовления имплантата, позволяя установить эндопротез наиболее соответствующий индивидуальным анатомическим размерам кости конкретного пациента из универсальных модулей. Требования предъявляемые к конструкции эндопротеза при первичном эндопротезировании у детей и подростков:
1. Модульность конструкции эндопротеза.
2. Максимальная надёжность и ремонтопрегодность эндопротеза
3. Универсальность компонентов эндопротеза
4. Максимальный срок службы;
5. Стабильная фиксация эндопротеза;
6. Хороший функциональный результат;
7. Короткий срок изготовления эндопротеза
IV.3 Лучевая терапия и современная химиотерапия
Лучевая терапия саркомы Юинга. Применяется дистанционная 3-D и интенсивно модулированная (IMRT) лучевая терапия в комбинации с химиотерапией при отказе или нерадикально выполненной операции в качестве локального лечения. РОД 2-2,5гр, СОД=60Гр. При метастазах в легкие – крупнопольная лучевая терапия РОД=2Гр, СОД=20Гр.
IV.4 Режимы химиотерапии:
- Чередование IE и VAC каждые 3-4 недели: IE этопозид 100 мг/м2 в/в в1-5 дни
ифосфамид 1,8 г/м2 в/в инфузия в1-5 дни с уромитексаном
VAC винкристин 1,5 мг/м2 в/в в 1 день
доксорубицин 75 мг/м2 в/в в1 день
циклофосфамид 1200 мг/м2 в/в в 1 день
- VACА винкристин 1,5 мг/м2 в/в в 1 день 1, 4, 7, 10, 13, 16, 19, 22, 25, 28, 31, 34, 37, 40 недели
доксорубицин 20 мг/м2 4-часовая в/в инфузия в1-3 дни1, 7, 13, 19, 25, 31, 37 недели
циклофосфамид 1200 мг/м2 в/в в 1 день 1, 4, 7, 10, 13, 16, 19, 22, 25, 28, 31, 34, 37, 40 недели
дактиномицин 0,5 мг/м2 4-часовая в/в инфузия в 1-3 дни 4, 10, 16, 22, 28, 34, 40 недели
- VAIА винкристин 1,5 мг/м 2 в/в в 1 день 1, 4, 7, 10, 13, 16, 19, 22, 25, 28, 31, 34, 37, 40 недели
доксорубицин 20 мг/м2 4-часовая в/в инфузия в1-3 дни 1, 7, 13, 19, 25, 31, 37 недели ифосфамид 2,0 г/м2 в/в инфузия в 1 день 1, 4, 7, 10, 13, 16, 19, 22, 25, 28, 31, 34, 37, 40 недели с уромитексаном дактиномицин 0,5 мг/м2 4-часовая в/в инфузия в 1-3 дни 4, 10, 16, 22, 28, 34, 40 недели 24 · CyVADIC циклофосфамид 600 мг/м2 в/в в 1 день
винкристин 1,4 мг/м2 в/в еженедельно, всего 6, затем в 1 день каждого цикла доксорубицин 60 мг/м2 в/в 96-часовая инфузия.

