Язвенная болезнь (ЯБ) является одним из самых распространённых хронических гастроэнтерологических заболеваний. Как известно, ЯБ желудка и двенадцатиперстной кишки (ЯБЖ и ЯБДПК) – это хронические полиэтиологические рецидивирующие заболевания, в основе механизма которых лежат сложные изменения нервных, гипоталамо-гипофизарно-надпочечниковых и местных гастродуоденальных процессов, приводящие к трофическим нарушениям в слизистой оболочке желудка и двенадцатиперстной кишки. Многие из них считают, что гипоталамо-гипофизарно-надпочечниковая ось играет существенную роль в развитии нарушений регуляции и возникновении дистрофических поражений желудка и двенадцатиперстной кишки [11].
Также актуальной проблемой во всем мире является развитие гастропатий при приеме нестероидных противовоспалительных средств (НПВС). Среди ятрогенных осложнений, возникающих при приеме НПВС, ведущая роль отводится НПВС-индуцированной гастропатии. Назначение ингибиторов протонной помпы (ИПП) позволяет снизить частоту осложнений НПВС со стороны желудочно-кишечного тракта.
Первым препаратом этой группы и является омепразол. Омепразол применяется для лечения и профилактики эрозивно-язвенных поражений слизистой оболочки желудка (СОЖ) и двенадцатиперстной кишки, вызванных НПВС [7]. Достаточно хорошо известен спектр побочных эффектов омепразола, в последние годы все большее внимание исследователей привлекает проблема повышения риска развития нейродегенеративных заболеваний на фоне приема омепразола [7].
Другой немаловажной проблемой современной медицины являются ятрогенные поражения печени, возникающие в результате приема лекарственных препаратов, которые служат основной причиной возникновения острой печеночной недостаточности [10]. Однако наиболее значимой проблемой остается возникновение гепатопатий на фоне применения НПВС. Существует несколько патогенетических механизмов, приводящих к гепатотопатии. Ряд авторов считают, что идиосинкразические реакции на лекарственный препарат являются одной из главных причин повреждения гепатоцитов. Считается, что этот механизм обусловлен образованием реакционноспособных метаболитов [6]. Помимо этого, предполагается, что в основе НПВС-индуцированной гепатотоксичности лежат иммунные реакции с участием цитокинов, фактора некроза опухолей – альфа, интерферона гаммa. При этом запускается универсальный патофизиологический механизм повреждения, связанный с синтезом свободных радикалов и продуктов перекисного окисления липидов (ПОЛ) [8]. В нескольких клинических исследованиях сообщалось, что НПВС (фенилбутазон, диклофенак, мелоксикам и т.п) ингибируют изоформы фермента уридин-5’-дифосфо-глюкуронозилтрансферазы (UGT), что приводит к уменьшению образования глюкоронидатов и как следствие приводит к накоплению токсических веществ [9]. Токсичное вещество может непосредственно воздействовать на структуру гепатоцита или оказывать опосредованное влияние на метаболические реакции (например, торможение синтеза белка), что можно выявить при определении стандартных биохимических критериев.
Сказанное выше обусловливает поиск лекарственных препаратов, имеющих минимум побочных эффектов и обладающих протективной активностью при НПВС-гастро- и гепатопатиях.
Кортексин – полипептидный препарат, разработанный сотрудниками Военно-медицинской академии имени С. М. Кирова (г. Санкт-Петербург). Эффективность кортексина отмечена при различных неврологических заболеваниях. Препарат стимулирует когнитивные функции, обладает нейропротекторной, нейтротрофической и антиконвульсантной активностью, оказывает иммуномодулирующий, антиоксидантный, метаболический эффекты. В составе комплексной терапии дисфункций желудочно-кишечного тракта у недоношенных детей кортексин (Корт) способствует восстановлению адекватной функциональной активности гастроинтестинальной системы посредством оптимизации центральных регулирующих влияний [1].
Цель исследования: изучить влияние кортексина (Корт) на состояние печени и слизистой оболочки желудка при воздействии фенилбутазона (ФБ).
Для достижения поставленной цели решались следующие задачи:
1. Изучить влияние кортексина на состояние слизистой оболочки желудка при воздействии ФБ.
2. Изучить влияние комбинированного применения кортексина и омепразола на состояние оболочки желудка при воздействии ФБ.
3. Изучить влияние ФБ на состояние печени.
4. Оценить влияние кортексина на состояние печени при воздействии ФБ.
Материалы и методы исследования. Эксперименты выполнены на 60 белых половозрелых крысах-самцах массой 200–220 г. Животные содержались в стандартных условиях вивария с естественным световым режимом, на стандартной диете лабораторных животных (ГОСТР 50258–92), с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях, а также правил лабораторной практики при проведении доклинических исследований в РФ (ГОСТ З 51000.3–96 и 51000.4–96) и Приказу МЗ РФ №267 от 19.06.2003 г. «Об утверждении правил лабораторной практики» (GLP).
Фенилбутазон (ФБ) вводили внутрибрюшинно однократно в дозе 200 мг/кг [3], омепразол (Омез) – в дозе 20 мг/кг per os за 30 минут до введения Фенилбутазона [5]. Кортексин вводили внутримышечно в течение 10 дней в дозе 1 мг/кг (Корт) [4] до введения Фенилбутазона.
Животные были разделены на 6 групп: 1 группа – Контроль; 2 группа – Фенилбутазон (ФБ); 3 группа – Фенилбутазон + Омепразол (ФБ + Омез); 4 группа – Кортексин 1 мг/кг (Корт); 5 группа – Фенилбутазон + Кортексин 1 мг/кг (ФБ + Корт); 6 группа – Фенилбутазон + Омепразол + Кортексин 1 мг/кг (ФБ + Омез + Корт). За сутки до введения ФБ крыс лишали еды при свободном доступе к воде. Через сутки после воспроизведения язвенного дефекта СОЖ и введения препаратов коррекции животных выводили из эксперимента, извлекали желудки и проводили макроскопическое исследование СОЖ [2]. Определяли уровень общего белка, альбумина, аланинтрансферазы (АЛТ), аспартаттрансферазы (АСТ), щелочной фосфатазы (ЩФ) .
Тяжесть поражения СОЖ и фармакологическую активность сравниваемых препаратов оценивали по следующим критериям [2]:
• структура и площадь деструкций СОЖ (точечные, полосовидные и крупные) в группе;
• общее количество дефектов (ОКД) СОЖ в группе и в пересчете на одну крысу;
• средняя площадь язвенных дефектов СОЖ в группе (Sя ср);
• частота выявления животных с язвами (Жя, %).
Градацию язвенного поражения проводили по Карташевской М.И. и Миронову А.Н. [3].
|
Градация язвенного поражения по Карташевской М.И. |
Оценка ульцерогенного действия фенилбутазона по Миронову А.Н.: |
|
1–2 мм2 – 1 балл; 3–5 мм2 – 5 баллов; 6–10 мм2 – 10 баллов; 10 и более мм2 – 15 баллов; в случае гибели животного от перфорации желудка интенсивность поражения оценивали в 15 баллов |
0 – отсутствие повреждения; 0,5 – гиперемия; 1 – единичные незначительные повреждения (1 или 2 точечных кровоизлияния); 2 – множественные кровоизлияния (эрозии, точечные кровоизлияния); 3 – значительные и множественные повреждения (эрозии, кровоизлияния); 4 – грубые повреждения, охватывающие всю поверхность слизистой (массивные кровоизлияния, эрозии, перфорации) |
Также рассчитывали интегральный показатель – язвенный индекс (ЯИ, ед.), а на основе последнего – противоязвенную активность препаратов коррекции ( %) [2]:
ЯИ = Sя ср × Жя/100
ПЯА = 100 % – (ЯИлеч × 100/ЯИк.)
Статистическую обработку проводили с использованием методов вариационной статистики, пакета программ Statistica 8.0. Проверку на нормальность распределения данных выполняли с помощью критерия Шапиро-Вилка. При нормальности распределения признака оценку значимости различий проводили с =использованием t-критерия Стьюдента. В других случаях вычисляли медиану и межквартильный интервал. Дисперсионный анализ проводили с помощью Н-критерия Краскела-Уоллиса, для множественных сравнений использован Q-критерий Дана. Критический уровень значимости р для статистических критериев принимали равным 0,05. Данные в тексте представлены в процентах к контролю.
Результаты исследования. При изолированном введении ФБ у всех (100 %) животных наблюдалось формирование язвенных дефектов СОЖ. В структуре язвенного поражения СОЖ количество точечных дефектов составило 54,3 %, полосовидных – 22,9 %, крупных – 22,9 % (рис. 2). На одну крысу приходилось 6,67 язвенного дефекта СОЖ, а средняя площадь язв составила 1,21 мм2 (рис. 3).
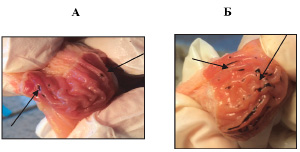
Рис. 1. Дефекты слизистой оболочки желудка при введении фенилбутазона:
А – крупные; Б – полосовидные
Применение стандартного препарата сравнения омепразола существенно ослабляло повреждающее воздействие ФБ. Так, количество животных с язвами снизилось в 4 раза. При этом количество точечных дефектов СОЖ уменьшилось в 14,5 раз, полосовидных – 6,1 раза, крупных – почти в 9 раз (рис. 2).
Применение омепразола уменьшило общее количество деструкций СОЖ в 17,5 раз, количество язв на 1 крысу уменьшилось в 10 раз (рис. 7), а средняя площадь язв сократилась до 0,29 мм2 – в 4,2 раза (рис. 4).
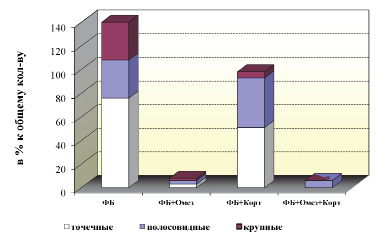
Рис. 2. Структура язвенных дефектов слизистой оболочки желудка у животных с фенилбутазоновыми язвами при применении омепразола и кортексина
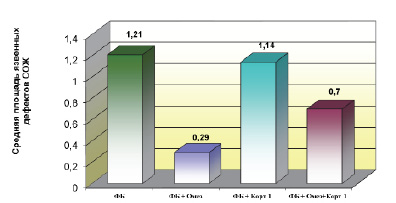
Рис. 3. Средняя площадь язвенных дефектов слизистой оболочки желудка у животных с фенилбутазоновыми язвами при применении омепразола и кортексина
Использование кортексина в дозе 1 мг/кг в течение 10 дней оказывало защитный эффект на СОЖ при воздействии ФБ. Так, количество животных с язвами снизилось на 40 %. При этом количество крупных дефектов СОЖ снизилось в 4,3 раза (рис. 2). Следует отметить, что количество полосовидных язв увеличилось в 1,9 раза (рис. 2). Установлено, что курсовое применение кортексина в дозе 1 мг/кг в 1,4 раза уменьшило общее количество деструкций СОЖ, а количество язв на 1 крысу – почти в 2 раза.
Эффективность сочетанного применения омепразола и кортексина (1 мг/кг, в течение 10 дней) была сопоставима с изолированным применением омепразола. Показано, что количество животных с язвами составило 33,3 %. При этом точечных и крупных дефектов СОЖ обнаружено не было, а все выявленные дефекты СОЖ относились к полосовидным (рис. 2). Общее количество язвенных дефектов СОЖ в группе, как и количество язв на 1 крысу, снизилось в 10 раз. Средняя площадь язв по сравнению с изолированным воздействием ФБ уменьшилась в 1,7 раза, а по сравнению с группой «ФБ + Омез» увеличилась почти в 2 раза (рис. 3). Следует отметить, что полное отсутствие крупных дефектов СОЖ у крыс в группе «ФБ + Омез + Корт » свидетельствует о снижении тяжести язвенного поражения (рис. 2).
При однократном изолированном введении ФБ животным наблюдалось статистически значимое изменение биохимических показателей по отношению к группе контроля. Отмечалось состояние гипопротеинемии, что подтверждается снижением содержания общего белка на 10 %, в том числе концентрации альбуминов – на 6.6 %. Кроме того, отмечается повышение уровня АСТ на 35 % на фоне снижения АЛТ – на 4 %, щелочной фосфатазы – на 2.4 %. Данные показатели функционального состояния печени доказывают токсическое воздействие ФБ на печень у 100 % экспериментальных животных
(рис. 4 А).
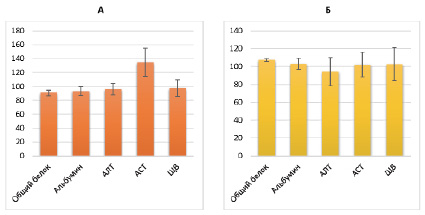
Рис. 4. Биохимические показатели групп:
А – «ФБ»; Б – «Корт»
Применение препарата «Кортексин» при сравнении с группой контроля достоверно повышало содержание общего количества белка на 7,2 %. Вместе с тем содержание альбуминов, уровень АЛТ, АСТ и ЩФ не отличался от таковых показателей интактных животных (рис.4 Б).
Применение комбинации ФБ и кортексина в дозе 1 мг/кг в течение 10 дней оказывало нормализующее влияние на функциональное состояние печени (рис.5 А). Так, сочетанное применение препаратов достоверно нормализовало содержание в крови общего белка и альбумина до показателей интактных крыс (до 93.7 % и 102.4 % по отношению к группе контроля соответственно). Также комбинация препаратов устраняла вызванное ФБ повышение уровня трансаминаз и щелочной фосфатазы. Об этом свидетельствует снижение уровня АСТ на 23 %, ЩФ на 3.9 %, восстановление концентрации АЛТ (до 101 % по отношению к интактным животным), статистически значимое по отношению к группе ФБ.
В группе животных, получавших комбинацию препаратов ФБ+Корт+Омез, концентрация общего количества белка снижается до 80.6 % по сравнению с контролем, количество альбумина – до 86.8 %. Кроме того, отмечается снижение уровня АСТ – на 7.8 %, АЛТ – на 35,5 %, щелочной фосфатазы – на 24 %,что достоверно по отношению к группе контроля, а также статистически значимо к группам «ФБ» и «ФБ+Корт» (рис. 5 Б).
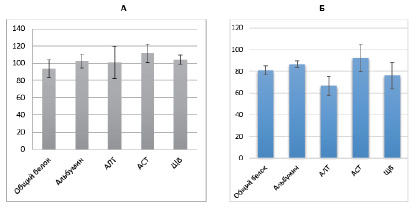
Рис. 5. Биохимические показатели групп:
А – «ФБ+Корт», Б – «ФБ+Корт+Омез»
Заключение и выводы
Введение фенилбутазона оказывало выраженное ульцерогенное действие на слизистую оболочку желудка экспериментальных животных, которое нивелировалось использованием омепразола.
Применение кортексина (1 мг/кг, в течение 10 дней) оказывало гастрозащитное действие на модели фенилбутазоновой язвы и не ухудшало противоязвенную активность омепразола.
При однократном введении фенилбутазона изменения показателей печени нивелировались курсовым применением кортексина в дозе 1 мг/кг в течение 10 дней.
Совместное применение кортексина и омепразола снижало биохимические показатели печени, что обосновывает необходимость дальнейшего изучения эффективности применения данной комбинации препаратов.
Результаты исследования доказывают необходимость продолжения изучения применения кортексина при гастро- и гепатотоксичности, вызванные действием ксенобиотиков.
Библиографическая ссылка
Асфандияров Э.Р., Киреева А.И., Султанова А.З., Исмагилова А.М., Гирфанова А.С. ВЛИЯНИЕ КОРТЕКСИНА НА СОСТОЯНИЕ ПЕЧЕНИ И СЛИЗИСТОЙ ОБОЛОЧКИ ЖЕЛУДКА ПРИ ВОЗДЕЙСТВИИ ФЕНИЛБУТАЗОНА // Международный студенческий научный вестник. – 2018. – № 4-7. ;URL: https://eduherald.ru/ru/article/view?id=19078 (дата обращения: 21.11.2024).

