Для моделирования изменения отдельных звеньев нейроэндокринной регуляции при стрессе используются разные методы: иммобилизация, введение гидрокортизона, активация β-адренорецепторов и др. Уровень глюкозы в крови изменяется под действием различных факторов: физическая активность, прием пищи, гормональные влияния и т.д. В стрессовых ситуациях организм начинает перестраиваться и реагировать должным образом, чтобы не вызвать дистресс или «отрицательный стресс». Интегральным показателем, отражающим перестройку метаболизма при стрессе под действием катехоламинов и глюкокортикоидов, является уровень глюкозы крови [1, 2, 4, 5, 6]. По уровню глюкозы в крови можно судить не только о реакции организма на стресс, но и его умении подавить излишний ответ, а также о способности нормализовать метаболизм при стрессе.
Цель исследования - оценка изменения метаболизма у мышей при введении гидрокортизона по интегральном показателю - уровню глюкозы крови.
Материалы и методы
Эксперименты выполнены на 10 белых мышах-самцах популяции SD1 средней массой 24,9 г. Уровень глюкозы оценивали с помощью специального прибора для измерения уровня глюкозы и кетоновых тел в органических жидкостях - глюкометра Abbott Optium Xceed (Abbott Diabetes Care Ltd). Прибор, по данным производителя, позволяет оценивать уровень глюкозы в 0,6 мкл крови (0,6 мкл), а концентрацию кетоновых тел в 1,5 мкл крови. В разных странах используются разные единицы измерения глюкозы крови: в России - преимущественно ммоль/л, в США - мг/дЛ или мг%. В работе производились вычисления и в тех, и в других единицах, используя формулу 1 ммоль/л = 18,016 мг/дЛ с использованием точной молекулярной массы глюкозы (180,016г/моль). Оценивали исходный уровень глюкозы до однократного внутрибрюшинного введения гидрокортизона в дозе 50 мг/кг массы тела, а затем через 3 и 6 часов после его инъекции. Кровь из сосудов хвоста мышей наносилась на тест-полоски FreeStyle Optium Blood Glucose Test Strip. Анализ результатов проводили с помощью методов описательной статистики.
Результаты и обсуждение
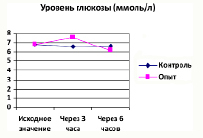
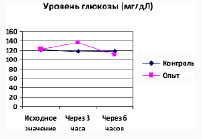
Исходные показатели уровня глюкозы до однократного внутрибрюшинного введения гидрокортизона у 10 белых мышей популяции SD1 (средняя арифметическая±стандартная ошибка) составляет 6,79±0,23 ммоль/л (122,33±4,14мг/дЛ). Через 3 ч после введения гормона концентрация глюкозы повышается до 7,54±0,34 ммоль/л (135,84±6,13 мг/дЛ) (p=0,0196 по t-критерию Стьюдента для парных данных). Через 6 часов после введения гидрокортизона уровень глюкозы снижается ниже исходного уровня и составляет 6,14±0,25 ммоль/л (110,62±4,50 мг/дЛ) (p=0,0399 по t-критерию Стьюдента для парных данных к показателям исходного фона; p=0,0020 по тому же критерию к показателям, полученным через 3 часа после введения гормона).
По данным литературы при иммобилизационном стрессе результаты получились аналогичные: двухфазное изменение уровня глюкозы крови под действием глюкокортикоидов [7].
В работе изображено, что наиболее чувствительной к стрессу как иммобилизационному, так и стрессу под действием гормональных влияний (моделирование стрессовых условий гидрокортизоном) является гипофизарно-надпочечениковая и симпато- надпочечниковая оси. Выявлено, что кратковременное сдерживание животного является мощным стрессором для него. Помимо повышения глюкозы в крови под действием катехоламинов и глюкокортикоидов можно отметить и другие явные изменения метаболизма, которые отмечаются у разных животных. При иммобилизационном стрессе отмечалось повышение кортизола в 7 раз, что свидетельствует о значительной роли гипофизарно-надпочечниковой оси при реакции на стресс. Концентрация глюкозы увеличивается в 1,47 раза (в данной работе изменение уровня глюкозы - в 1,1 раз в первую фазу). Кроме того, повышение свободных жирных кислот в 3,2 раза за 15 минут и значительный коэффициент корреляции (0,91) между кортизолом и свободными жирными кислотами свидетельствует о запуске липолиза при стрессе [8].
Но, кроме того, следует вспомнить и о других видах стрессоров, например, плавание. Разные стрессоры интересны тем, что они вызывают разную реакцию организма: в большей или меньшей мере активируется та или иная система. Вывод делается при сравнении уровня гормонов с исходным фоном. Например, у крыс при изоляции наблюдается повышение кортикостерона и АКТГ по сравнению с базальным уровнем, а уровни адреналина и норадреналина не изменяется существенно. То есть можно судить об активации в основном гипофизарно-надпочечниковой оси и выработке глюкокортикоидов. В других же ситуациях, наоборот, приемущественно активируется симпато-надпочечениковая ось и отмечается повышение катехоламинов. При принудительном плавании АКТГ в крови не повышается, при сочетании двух этих стрессоров отмечается повышение АКТГ в крови [9].
Обсуждая полученные результаты в сопоставлении с данными литературы, можно полагать, что повышение уровня глюкозы крови через 3 часа после введения гормона связано, с одной стороны, с увеличением глюконеогенеза в печени - метаболического пути, приводящего к образованию глюкозы из неорганических соединений (лактата, пирувата, глицерола, метаболитов цикла трикарбоновых кислот, некоторых аминокислот и т.д.). С другой стороны, повышение уровня глюкозы связано с ингибированием синтеза гликогена и одновременной мобилизацией глюкозы из гликогена, ингибирования утилизации глюкозы в дихотомическом пути и пентозном цикле, которые являются главными метаболическими путями, поставляют максимальное количество энергии и основные метаболиты (пентозы, НАДФН+Н+, глюкозо-6-фосфат), а также обеспечивают сгорание других моносахаров, помимо гексоз. В частности, за счет ингибирования ключевых ферментов гликолиза [1], а также повышения функциональной экспрессии бета-адренорецепторов [6] обеспечивается повышение уровня глюкозы крови. Через бета-адренорецепторы реализуется повышение чувствительности тканей к эндогенным катехоламинам. В свою очередь эндогенные катехоламины активируют аденилатциклазу посредством G-белка при лиганд-рецепторном взаимодействии. Дальнейшая активация фосфорилазы приводит к мобилизации глюкозы из гликогена. Помимо активации фосфорилазы эндогенные катехоламины ингибируют синтез гликогена посредством воздействия на гликогенсинтетазу [1, 4, 6].
Смысл данных механизмов заключается в мобилизации и перераспределении энергетических ресурсов в активно работающие органы при стрессовых ситуациях в частности: сердце, мозг, отчасти в печень и почки. Глюкокортикоиды наряду с катехоламинами уменьшают секрецию инсулина и помимо гипергликемического эффекта, наблюдаемого нами в ходе эксперимента, также снижается и захват глюкозы инсулинозависимыми ткаными и органами. Но для сердца, мозга и почек доступность глюкозы повышается в связи с наличием клеток этих органов как инсулинозависимых, так и инсулинонезависимых систем захвата и метаболизма глюкозы. А процесс гликогенолиза, о котором говорилось ранее, компенсирует как недостаток глюкозы в инсулинозависимых тканях, так и ее недостаток при распределении энергетических ресурсов в нуждающиеся при стрессе органы. Кроме того, глюкокортикоиды увеличивают синтез белка в сердце, печени, органах ЦНС и повышают его распад в коже, скелетных мышцах, лимфоидной и жировой ткани (активация липолиза).
Снижение уровня глюкозы через 6 часов после инъекции гидрокортизона, может быть, связано, с одной стороны, с окончанием действия гормона. Время действия гормона в среднем составляет порядка 4 часов. С другой же стороны, было отмечено, что уровень глюкозы крови снижается ниже исходного, что позволяет предположить об активации продукции инсулина - гормона пептидной природы, который образуется в бета-клетках островков Лангерганса поджелудочной железы. Инсулин является анаболиком и характеризуется белоксберегающим эффектом, усиливает все этапы синтеза белка, повышает сродство клеточных мембран к аминокислотам, увеличивает синтез липопротеинов низкой плотности (ЛПНП), липопротеинов очень низкой плотности (ЛПОНП) и триацилгрицеролов (ТАГ), активирует ацетил-КоА-карбоксилазу и синтетазу жирных кислот. Но самый ярко выраженный эффект инсулина, который отражен в данной работе, - воздействие на уровень глюкозы крови. Гормон способствует снижению уровня глюкозы за счет увеличения проницаемости клеточных мембран для глюкозы и усиления потребления ее тканями, активации всех процессов утилизации глюкозы, с одной стороны (гликолиз, аэробный распад глюкозы, пентозный цикл, синтез гликогена), и подавления процессов синтеза глюкозы, с другой стороны (глюконеогенез, гликогенолиз). Так, если при выработке глюкокортикоидов все процессы организма направлены на перераспределение ресурсов в сторону снабжения энергией такие органы, как сердце, мозг, почки, печень, то при нормализации метаболизма, т.е. в постстрессорный период процессы организма направлены на обеспечение энергией всех клеток и тканей. Мозг, сердце, печень и почки получают меньшее количество энергии, нежели в период стресса [1,3].
По изменению уровня глюкозы крови в стрессовой ситуации и в постстрессорный период можно судить о способности организма реагировать должным образом. При общем адаптационном синдроме имеет место развитие нескольких стадий. Это стадия тревоги, включающая «шок» и «противошок», стадия резистентности и стадия истощения. На первой стадии устойчивость организма к повреждающему фактору временно снижается. На стадии резистентности происходит выравнивание нарушенного равновесия, происходит устойчивое повышение секреции глюкокортикоидов, и повышается устойчивость организма к действию ряда раздражителей. Если действие стрессора прекращается или оно незначительно, то вызванные изменения постепенно нормализуются. Если же имеют место повторные стрессорные воздействия или же длительное воздействие стрессора, они способны истощать защитные силы организма. Патогенез общего адаптационного синдрома включает в себя следующие процессы: воздействие стрессора, раздражение периферических сенсорных систем, возбуждение ЦНС (в частности коры и лимбической системы), возбуждение гипоталамуса (среднего отдела и заднего симпатического отдела), выработка кортиколиберина, стимуляция аденогипофиза, повышение синтеза адренокортикотропного гормона и повышение функции коры надпочечников, секреция глюкокортикоидов. Так, сбой на любом из этих этапов может спровоцировать развитие тяжелых состояний, дистресс и нарушение важных метаболических процессов. Введение глюкокортикоидов, т.е. имитация стресса, а не, например, вызов иммобилизационного стресса, лишает возможности наблюдения возможных нарушений механизмов адаптационного стресса на высших уровнях регуляции.
Если же в стрессовых ситуациях изменение уровня глюкозы в крови не наблюдается или оно извращено, то следует говорить о нарушении адаптационных реакций и развитии стрессорных повреждений, что часто возникает при «излишнем», «отрицательном» стрессе или «дистрессе», который характеризуется негативным воздействием на организм в целом. Известно, что помимо перечисленных механизмов действия глюкокортикоидов, имеется и такой, как развертывание иммунологических механизмов защиты организма. Но если концентрация глюкокортикоидов окажется чрезмерной, что бывает при «отрицательном» стрессе, то сами же гормоны начинают угнетать механизмы защиты, что не только провоцирует развитие и размножение микроорганизмов, попавших в организм, но и усугубляет патогенность стресса. Нарушение механизмов защиты можно рассматривать как результат функциональной недостаточности коры надпочечников и нарушения равновесия между провоспалительными и противовоспалительными кортикостероидами. При кратковременном стрессе вырабатываются противовоспалительные (кортизол, кортикостерон) гормоны, но при переходе стресса в хроническое состояние происходит и смена гормонов на провосполительные (альдостерон, дозоксикортикостерон), что в частности и приводит к развитию заболеваний воспалительного характера.
Особенно нарушение адаптационных реакций наблюдается у лиц с функциональной недостаточностью симпатоадреналовой или гипоталамо-гипофизарной системы. В этих случаях может отсутствовать стадия резистентности к стрессу, что приведет к быстрому развитию «дистресса». Нужно сказать, что неизбежными компонентами стресса являются оксидативный и клеточный стресс, дестабилизация клеточных мембран и высвобождение протеолитических компонентов в плазму крови и цитоплазму и т.д. Как результат всех этих процессов - «стресс-болезни», среди которых: язвенная болезнь желудка и двенадцатиперстной кишки, иммунодефициты, онкозаболевания, ожирение, сахарный диабет, артриты, воспалительный реакции, гипертоническая болезнь, импотенция, бесплодие и т.д. Все эти заболевания являются результатом неадекватной приспособительной реакции организма. В случае «излишнего» стресса или же при отсутствии стадии резистентности сами механизмы «адаптации» являются сильнейшим патогенным фактором.
Кроме того, следует говорить о перенапряжении ЦНС и истощении механизмов адекватной реакции на стресс, которые возникают при растрачивании ресурсов нейроэндокринного аппарата или влиянии раздражителей, превышающих его функциональные ресурсы. При кратковременных стрессовых ситуациях измененные функции быстро приходят в норму, но при длительном отрицательном эмоциональном стрессе происходят необратимые изменения в звеньях саморегуляции за счет непрерывных влияний ЦНС на соматовисцераные функции. В этом случае развиваются психосоматические и нервно-психические расстройства, которые часто обусловлены генетической предрасположенностью и избирательным вовлечением того или иного органа в патологический процесс, но определенным толчком в развитии заболеваний является состояние организма в стадии истощения.
В длительном стрессовом состоянии и при экстремальных ситуациях могут формироваться «порочные круги». В этом случае патогенетический фактор становится причиной замкнутого комплекса нарастающих по степени нарушений. Зачастую последствия стрессорного воздействия потенцируют патогенное действие не только на органы и системы организма, но и на стрессорный фактор (в частности эндогенный), даже в условиях прекращения его действия. Чаще это бывает связано с психическим напряжением ЦНС и усиленной работой мозга, которые в дальнейшем не только истощаются, но и пытаются продолжать работать в режиме «получающих стрессовое воздействие», даже если таковое прекратилось. На фоне этого усугубляются нарушения. Отмечается недостаточность функций органов и физиологических систем, значительное отклонение от нормы показателей гомеостаза, повреждение субклеточных структур, клеток и нарушение межклеточных взаимодействий. В виду этого развиваются и нарушения психического состояния, агрессивное поведение или же апатия, фобии и сильнейшее истощение систем антистрессорной защиты и всего организма в целом.
Для коррекции стресс-реакции и предотвращения развития дистресса выполняется оптимизация стрессинициирующих систем организма (симпатоадреналовой, гипоталамо-гипофизарной). Исходный уровень активности этих систем у разных представителей различен. В связи с этими особенностями возможно развитие патологических реакций на стресс - либо чрезмерных, либо недостаточных. Для предотвращения развития патологичекой реакции с целью нормализации состояния систем используют корректоры баланса: катехоламины, адреноблокаторы, глюко - и минералокортикоиды, их антагонисты и др. Для предупреждения агрессивных реакций, психастении, раздражительности, напряженности используют транквилизаторы.
Кроме того, известно, что стресс негативно влияет и на деятельность органов и систем. Для избежания непоправимых последствий используются блокаторы механизмов повреждения: нарушений энергообеспечения, расстройств местных систем саморегуляции, дисбаланса ионов и воды, альтерации мембран и ферментов, изменений генетической программы клеток. Происходит активация центральных и периферических антистрессорных механизмов. Для этого приминаются препараты ГАМК, антиокидантов, аденозина или же вызывается стимуляция синтеза этих веществ в тканях.
Глюкокортикоиды, в частности гидрокортизон, относятся к стероидным гормонам из подкласса кортикостероидов. Они являются катаболическими гормонами во всех тканях, кроме печени, активируют глюконеогенез, препятствуют синтезу заменимых аминокислот, тормозят транспорт аминокислот в ткани и усиливают их распад. Выделение глюкокортикоидов в недостаточном или чрезмерном количестве при стрессовой ситуации может не только нарушить работу антистрессовых систем, снизить резистентность организма к стрессу, но и привести к развитию патологических состояний, болезней. Длительной или очень сильное стрессорной воздействие вызывает в организме механизмы «дистресса», что включает стадию истощения органов, функциональных систем и всего организма.
Основная физиологическая функция глюкокортикоидов - мобилизация глюкозы для обеспечения энергетики мышц и других органов при противодействии стрессорным воздействиям [1, 3].
Выводы
Выявлено непосредственное влияние гормона на обменные процессы, которое отражается в двухфазном изменении уровня глюкозы при введении гидрокортизона: повышении ее концентрации через 3 часа после инъекции гормона с последующим снижением ее уровня ниже исходного через 6 часов. Полученные результаты соответствуют литературным данным. Изучены механизмы развития стрессового состояния и патологического «дистресса».
Библиографическая ссылка
Залаева А.Б. ВЛИЯНИЕ ГЛЮКОКОРТИКОИДОВ НА УРОВЕНЬ ГЛЮКОЗЫ В КРОВИ У МЫШЕЙ // Международный студенческий научный вестник. – 2018. – № 4-2. ;URL: https://eduherald.ru/ru/article/view?id=18503 (дата обращения: 21.11.2024).

