Введение.
Важным моментом в изучении функционирования нервной системы, как в рамках исследовательской, так и образовательной деятельности является регистрация биоэлектрической активности возбудимых тканей. Регистрация биопотенциалов может выполняться как инвазивным (при помощи игольчатых, или иных электродов, внедряемых непосредственно в исследуемые ткани и органы), так и не инвазивным способом – при помощи электродов, прикладываемых к поверхности кожи. Основным инструментом для этого до сих пор является усилитель биопотенциалов (УБП).
Серийно изготавливаемые усилители биопотенциалов зачастую достаточно дороги, что делает их малодоступными для исследовательских организаций в развивающихся странах. Например, нейрофизиологическое оборудование начального уровня обычно стоит более 3 тыс. долларов и требует основательной подготовки перед использованием [3].
Имеется ряд проектов по созданию доступных усилителей биопотенциалов самого различного назначения, например, для регистрации ЭМГ, ЭКГ, ЭЭГ, [10] так же существуют работы, посвященные созданию простых и компактных моделей УБП для микроэлектродной регистрации биопотенциалов методом patch-clamp [5] и экстраклеточной регистрации нейронной активности [2].
Одним из примеров недорогой и доступной системы для регистрации биопотенциалов является SpikerBox от компании Backyard Brains. Имеются версии как для записи поверхностной электромиографии, так и для регистрации экстраклеточной нейронной активности. Есть различные комплектации прибора – от полностью собранного и готового к работе устройства [9], до различных вариаций комплектов для самостоятельной сборки, представленных полным набором всех необходимых деталей, либо только готовой печатной платой [8]. Электронная схема данного усилителя биопотенциалов имеется в открытом доступе и доступна для самостоятельного воспроизведения даже для человека с начальными познаниями в электронике.
Несмотря на позиционирование данного устройства разработчиками в первую очередь для работы с беспозвоночными, большой интерес представляет потенциальная возможность регистрации нейронной активности позвоночных животных.
Цель данной работы – проверка возможности использования системы SpikerBox для экстраклеточной записи нейронной активности позвоночных животных.
В задачи данной работы входило:
1) Предварительное тестирование работоспособности SpikerBox на беспозвоночных по стандартным методикам, предлагаемым производителем.
2) Изготовление простых, совместимых со SpikerBox электродов, пригодных для использования на нервах позвоночных животных.
3) Проведение посредством SpikerBox экстраклеточной регистрации электрической активности волокон седалищного нерва лягушки при раздражении тактильных рецепторов
4) Выполнить сравнение характера сигнала, записанных нервных импульсов беспозвоночного и позвоночного животного.
Материалы и методы
Животные и подготовка препаратов для записи биопотенциалов
Беспозвоночные. Разработчиками приводится множество примеров использования SpikerBox в различных экспериментах и с различными беспозвоночными животными – дождевыми червями [6], кузнечиками [4], тараканами четырех различных видов - Blaberus discoidalis, Blaberus fusca, Americana periplaneta (Американский таракан), Gromphadorhina portentosa (Мадагаскарский шипящий таракан) [3].
В качестве объекта для тестирования на беспозвоночных в данной работе был выбран мадагаскарский шипящий таракан (Gromphadorhina portentosa). Данные насекомые легкодоступны, достаточно просты в содержании, при этом обладают значительными размерами, что облегчает проведение различных манипуляций над ними.
В качестве базового эксперимента с системой SpikerBox производителем предлагается экстраклеточная регистрация потенциалов действия при раздражении механочувствительной трихоидной сенсиллы на ноге таракана. [7], [3].
Порядок подготовки препарата ноги таракана был следующий:
1) Таракан анестезируется путем охлаждения в воде со льдом. Обездвиживание таракана является индикатором успешной анестезии.
2) Нога, включая бедро, отсекается при помощи ножниц.
3) Таракан возвращается в место содержания.
4) Нога двумя булавками-электродами фиксируется на пробковой подложке. Один электрод необходимо ввести в голень, имеющую достаточно крупные трихоидные сенсиллы, второй вводится в бедро. [7].
Позвоночные. В качестве представителя позвоночного была выбрана лягушка в силу простоты доступа к седалищному нерву и удобству манипуляций с ним. Так же использование в качестве объекта для работы с позвоночными животными лягушки укладывается в общую идеологию усилителя биопотенциалов SpikerBox – из всех позвоночных животных лягушка является одним из наиболее доступных и простых в содержании.
Подготовка препарата начиналась с обездвиживания лягушки путем разрушения головного и спинного мозга при помощи зонда. Кожа на задней конечности была рассечена продольным разрезом, при помощи стеклянных крючков был выделен седалищный нерв и зафиксирован на отдельной диэлектрической подложке из пенополистерола, после чего в нерв были введены электроды на расстоянии ~ 1,5 см друг от друга. В процессе выделения нерва, а также при проведении эксперимента необходимо избегать контакта нерва с кожей лягушки, для предотвращения пересыхания нерва, каждые 5 минут выполнялось его увлажнение физиологическим раствором. Важным моментом являлось сохранение кожи на дистальной части конечности лягушки, поскольку планировалось регистрировать сигнал от расположенных в ней тактильных рецепторов.
Аппаратная и программная часть.
В качестве усилителя биопотенциалов использовался SpikerBox производства Backyard Brains. При помощи экранированного кабеля SpikerBox был подключен к микрофонному входу аудиоплаты ноутбука, для записи, графического отображения и изучения сигнала использовалась свободная программа для работы с аудиофайлами – Audacity. Так же выполнялось звуковое дублирование сигнала. Во-избежание синфазной помехи 50Гц от сети питания, в момент записи биопотенциалов ноутбук отсоединялся от неё и работал от батареи.
Использовались игольчатые электроды двух типов – стандартные электроды SpikerBox - для работы с препаратом ноги таракана, диаметром 0,6 мм, и модифицированные электроды, обладающие меньшим диаметром – для работы с препаратом седалищного нерва лягушки. Достижение приемлемой толщины электродов для работы с седалищным нервом осуществлялось при помощи электролитической заточки. Обе версии электродов были изготовлены из нержавеющей стали.
Выполнение регистрации и записи биопотенциалов.
В обоих случаях регистрировались сигналы от тактильных рецепторов – трихоидных сенсилл у таракана и тактильных рецепторов кожи задней конечности лягушки. Чувствительные рецепторы стимулировались при помощи щупов, изготовленных из диэлектрического материала - дерева. На ноге таракана выполнялось отклонение сенсилл, расположенных рядом с электродом, введенным в голень. Тактильные рецепторы лягушки стимулировались путем нанесения щупом штрихообразных раздражений кожи внутренней стороны дистальной части задней конечности. В режиме реального времени сигнал отображался на мониторе компьютера в окне программы Audacity, а также в звуковой форме выводился на динамики.
Результаты исследования
Беспозвоночные. При отклонении трихоидной сенсиллы на ноге таракана деревянным щупом, наблюдались пачки нервных импульсов, отчетливо выделяющиеся по амплитуде и характеру на фоне шума, и по частоте следования превосходящие фоновую активность. При анализе записи можно было отчётливо выделить одиночные потенциалы действия. Полученные данные были аналогичны таковым, описанными производителем [3], что говорит о работоспособности усилителя биопотенциалов SpikerBox, правильной подготовке препарата и выполнении записи сигналов.
Позвоночные. В момент нанесения штриховых раздражений на кожу лягушки при помощи деревянного щупа, как и при воздействии на сенсиллу ноги таракана, появлялись пачки импульсов, выделяющиеся на фоне шума как по амплитуде, так и своим характером (см. рис.1).
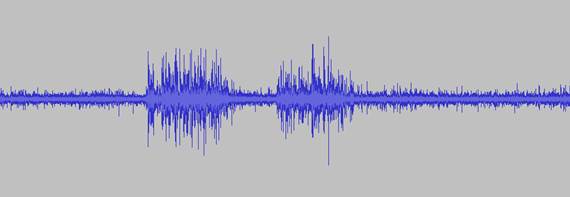
Рис.1. Запись электрической активности седалищного нерва лягушки
При этом, при работе с седалищным нервом лягушки выделить отдельные импульсы было несколько сложнее, чем при работе с препаратом ноги таракана, поскольку, в отличие от трихоидных сенсилл насекомых, зачастую иннервируемых одиночными нейронами [1], на коже лягушки единовременно активировалось большое количество рецепторов, в результате чего, неизолированные электроды получали электрические импульсы одновременно от большого количества чувствительных волокон седалищного нерва.
Выводы. Проанализировав записанную электрическую активность седалищного нерва лягушки в покое и при нанесении штриховых механических раздражений на кожу задней конечности, а, так же сопоставив её с записью электрической активности чувствительного нейрона трихоидной сенсиллы ноги таракана, можно сделать ряд выводов:
1) SpikerBox является устройством, принципиально применимым при записи биопотенциалов не только беспозвоночных, но и позвоночных животных.
2) Выполнение записи биопотенциалов нервных волокон позвоночных не представляет большой сложности и так же доступно, как и работа с беспозвоночными, хоть и требует ряд дополнительных навыков.
3) Процесс работы с позвоночными так же нагляден, как и с беспозвоночными - в процессе регистрации четко отслеживается причинно-следственная связь между раздражением тактильных рецепторов и всплесками электрической активности чувствительных нейронов.
4) Из предыдущего пункта следует, что SpikerBox применим в учебном процессе при изучении физиологии возбудимых тканей позвоночных.
В дальнейшем планируется использовать SpikerBox с более совершенными изолированными электродами, позволяющими выполнять более селективную запись сигналов с отдельных волокон для проведения более сложных экспериментов с нервной системой позвоночных.
Библиографическая ссылка
Кравченко С.В. ОПЫТ ИСПОЛЬЗОВАНИЯ СИСТЕМЫ SPIKERBOX ДЛЯ РЕГИСТРАЦИИ ЭЛЕКТРИЧЕСКОЙ АКТИВНОСТИ ВОЛОКОН СЕДАЛИЩНОГО НЕРВА ЛЯГУШКИ // Международный студенческий научный вестник. – 2017. – № 5. ;URL: https://eduherald.ru/ru/article/view?id=17506 (дата обращения: 21.11.2024).

