Система гемостаза (haemostasis от греч. haima кровь и stasis – стояние) – совокупность биологических и биохимических механизмов, обеспечивающих сохранение жидкого состояния циркулирующей крови, поддержание целостности кровеносных сосудов и купирование кровотечения при их повреждении [3].
До настоящего времени для понимания механизмов гемостаза использовали «каскадную» модель (водопада) процесса свертывания крови. Она была предложена в 1964 г., двумя независимыми группами учёных (Davie E.W., Ratnoff O.D., Macfarlane R.G.), где процесс свертывания крови подразделяется на первичный, или сосудисто-тромбоцитарный, гемостаз и вторичный, или коагуляционный, гемостаз, с выделением в последнем «внешнего», «внутреннего» путей активации тромбина и «общего пути» (см. рис. 1). Своего рода третьим этапом свертывания крови является процесс лизиса кровяного сгустка (фибринового тромба) – фибринолиз [1]. Эта модель сохраняет свое значение только как отражение процессов свертывания крови in vitro. Ставшее классическим словосочетание «коагуляционный каскад» не совсем верно отражает суть функционирования системы гемостаза. «Каскад» подразумевает простую однонаправленную цепочку событий, в то время как в процессе коагуляции имеется множество перекрёстных реакций. С одной стороны, действуют силы самоусиления, в результате чего каждый предшествующий фактор вовлекает в процесс активации не такое же, а значительно большее количество молекул последующих факторов, а с другой стороны, механизм самоторможения [2].
«Каскадная» модель свертывания крови, объясняющая этапность процесса свертывания крови in vitro, не объясняет остановку кровотечения in vivo. Прежде всего, она не отвечает на вопрос, почему возможность образования протромбиназы (активатора тромбина) по одному пути не компенсирует поломку в другом. В последнее время получены убедительные данные о том, что в организме человека оба пути тесно связаны между собой и с тромбоцитами. На основе этих знаний разработана «клеточная» модель свёртывания крови (cell-based model of coagulation), призванная описать процессы гемокаогуляции in vivo и объяснить ограничения, которые необходимо учитывать при интерпретации результатов лабораторных коагуляционных тестов. Эта теория была предложена Н.Hoffman в 2001 г.[4].
Основные идеи современной концепции свертывания крови in vivo:
1. In vivo процесс свертывания крови является единым и связан с гемостатическими реакциями тромбоцитов. Тромбоциты не только участвуют в активации коагуляционных факторов, но и выполняют функцию регуляции всего процесса свертывания крови.
2. Коагуляционный процесс в физиологических условиях локализован зоной дефекта сосуда. Его нераспространению способствуют противосвертывающая система и нормально функционирующие эндотелиоциты.
3. Избыток тромбина в организме человека инактивируется антитромбином III, который также активен в отношении факторов XIIa, XIa, IXa, Xa.
4. Поддержанию крови в жидком состоянии способствуют ретикулоэндотелиальная система и гепатоциты посредством специфического удаления активированных факторов свертывания крови и фибриногена без какого-либо влияния на предшественники, путем ограничения распространения коагуляции при участии ингибитора пути тканевого фактора (tissue factor path way inhibitor, TFPI), тромбомодулина, гепариноподобных гликозаминогликанов поверхности эндотелиоцитов.
Современная модель вторичного гемостаза включает три фазы (см. рис. 2):
• инициации, или стартового сигнала (образуется комплекс «тканевой фактор (ТФ)/фактор VIIа» на поверхности субэндотелия в месте повреждения, что сопровождается продукцией тромбина);
• усиление процесса (под воздействием тромбина активируется целый ряд коагуляционных факторов);
• распространение процесса (формируются теназный (VIIIа/IXа) и протромбиназный (Vа/Xа/кальций/фактор III тромбоцитов) комплексы, что провоцирует так называемый тромбиновый взрыв и образование стабильного сгустка фибрина) [4].
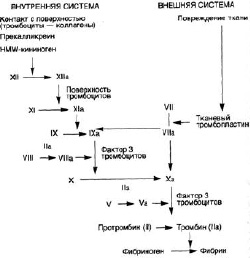
Рис. 1. Каскадная модель коагуляционного гемостаза (1964 г.)
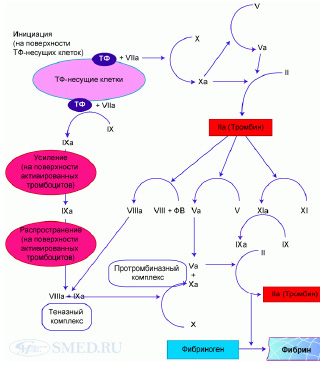
Рис. 2. Клеточная теория свёртывания крови (ТФ – тканевой фактор; ФВ – фактор Виллебранда)
Рассмотрим более подробно каждую фазу клеточной модели:
I. Инициация: в первую фазу (инициации) на поверхности клеток, содержащих ТФ, происходит активация ФVII (в физиологических условиях ТФ содержат фибробласты, гладкомышечные клетки сосудов; при воспалении ТФ-несущими становятся эндотелиальные клетки, моноциты; при ряде патологических состояний, включая антифосфолипидный синдром – нейтрофилы). При повреждении сосудистой стенки клетки, несущие ТФ, начинают контактировать с плазмой. Одновременно обнажаются субэндотелиальные структуры (коллаген), что приводит к скоплению в этой области тромбоцитов (адгезия). ТФ связывается с ФVII с образованием комплекса ТФ/ФVIIa. Этот комплекс локально на поверхности ТФ – несущих клеток активирует ФX и ФIX. Фактор IXa мигрирует и связывается с поверхностью тромбоцитов, в то время как фактор Xa остаётся на поверхности клеток, несущих ТФ (его переносу на поверхность тромбоцитов препятствуют плазменные ингибиторы (ИПТФ), АТ III, которые мгновенно инактивируют ФXa; на ФIXa ИПТФ не влияет, а АТ III – значительно слабее, чем на ФXa). Согласно клеточной модели, фактор IXa не играет существенной роли в первую фазу коагуляции. Фактор Xa активирует ФV. В результате, образовавшийся на поверхности ТФ-несущих клеток комплекс ФXa/ФVa расщепляет протромбин (ФII) с образованием небольшого количества тромбина (ФIIa) – ключевого фактора последующего усиления активации системы свёртывания.
II. Усиление: реакции фазы усиления (амплификации) происходят на поверхности тромбоцитов. Пространственное разделение процессов коагуляции (фаза инициации – на поверхности ТФ-несущих клеток, фаза усиления – на поверхности тромбоцитов) – один из механизмов ограничения их выраженности при отсутствии необходимости в свёртывании крови. Небольшое количество тромбина, образовавшегося в фазу инициации, активирует тромбоциты, факторы V, VIII и XI. Тромбин способствует высвобождению ФVIII из комплекса с фактором Виллебранда, в результате образуется ФVIIIa. Активированный ФXI (ФXIa) приобретает способность связываться с поверхностью тромбоцитов. Активированные небольшим количеством образовавшегося в фазу инциации тромбина факторы в следующую фазу (фазу распространения) обеспечивают формирование на тромбоцитарной матрице огромного количества тромбина, которое способно перевести фибриноген в фибрин. Таким образом, вышедший из фазы инциации тромбин выступает в качестве мощного усилителя коагуляции.
III. Распространение: в фазу распространения на поверхности активированных тромбоцитов формируются теназный (ФVIIIa/ФIXa) и протромбиназный (ФVa/ФXa) комплексы. ФVIII активируется в фазу усиления и фиксируется на тромбоцитах. ФIXa переносится на поверхность тромбоцитов с места активации (поверхность ТФ-несущих клеток) ещё в фазу инициации; дополнительное его количество образуется на тромбоцитах под действием образованного в фазу усиления ФXIa. Теназный комплекс на поверхности тромбоцитов активирует ФX, связанный со своим кофактором ФVa (пришедшим из фазы усиления). Образовавшийся протромбиназный комплекс обеспечивает лавинообразное нарастание уровня тромбина. Тромбин переводит фибриноген (ФI) в фибрин (ФIa), а также активирует ФXIII, обеспечивающий стабилизацию фибриновых нитей и образование множества ковалентных перекрёстных связей между ними [2].
Таким образом, ставшее классическим словосочетание «коагуляционный каскад» не совсем верно отражает суть функционирования системы гемостаза. «Каскад» подразумевает простую однонаправленную цепочку событий, в то время как в процессе коагуляции имеется множество перекрёстных реакций, что необходимо учитывать в диагностике и лечении патологии гемостаза.
Библиографическая ссылка
Шишонок А.И., Щербакова И.Г., Гребенникова И.В. СОВРЕМЕННЫЕ АСПЕКТЫ ГЕМОСТАЗА // Международный студенческий научный вестник. – 2015. – № 2-1. ;URL: https://eduherald.ru/ru/article/view?id=12222 (дата обращения: 22.11.2024).

