Основной причиной распространения микроорганизмов в различных экологических условиях является их способность к адаптации, которая усиливает резистентность к неблагоприятным условиям среды. Данная устойчивость характеризуется: клеточной дифференциацией в специализированных структурах [1] и специфической индукцией генов стресс-ответа, усиливающих метаболическую устойчивость вегетативных клеток [2].
К инфекционным болезням относится большая группа заболеваний, которые вызывают патогенные возбудители. Главное отличие инфекционных заболеваний – контагиозность, т.е. данные болезни передаются от больных людей или животных к здоровым. Для данных болезней характерны специфичность возбудителя, цикличность течения и формирование в процессе болезни иммунитета. Инфекционные заболевания способны к массовому (эпидемическому) распространению [3].
Особое значение уделяется инфекционным поражениям желудочно-кишечного тракта (ЖКТ). Возбудителями данных поражений являются патогенные и условно-патогенные микроорганизмы [4]. Помимо этого, заболевания ЖКТ могут вызываться вирусами и некоторыми протозоа. Общим для этой группы инфекций является орально-фекальный путь заражения (через пищу, воду). В зависимости от особенностей возбудителя инфекции, патогенеза, характера течения и тяжести процесса, определяющих тактику терапии, каждое заболевание в зависимости от этиологии рассматривается отдельно [5, 6].
В настоящее время глобальное распространение сальмонеллеза, рост заболевания, развитие вспышек внутри больниц, антибиотикорезистентность возбудителя, тяжесть течения локализованных форм и высокая летальность при генерализованных формах служат причиной многочисленных исследований.
Целью исследования является изучение влияния дикого Salmonella typhimurium 14028S WT и генномодифицированного штаммов Salmonella typhimurium 14028S ΔluxS на организм лабораторных животных. В данной работе представлены данные по определению количества колониеобразующих единиц (КОЕ) S. typhimurium 14028S ΔluxS, S. typhimurium 14028S WT в фекалиях и крови лабораторных животных
В качестве объектов исследования нами использовались: S. typhimurium 14028S WT – дикий штамм, S. typhimurium 14028S ΔluxS – в данном штамме вырезан ген luxS, который отвечает за кодирование белка LuxS (синтаза аутоиндукторов II типа) и белка S-рибозилгомоцистеинлиазы (семейство углерод-сералиаз, катализирует реакцию расщепления S-(5-дезокси-D-рибозил-5)-L-гомоцистеина).
В качестве модели in vivo в эксперименте были использованы лабораторные крысы линии Wistar в количестве 27 штук. Животные отбирались в соответствии общепринятых принципов подбора аналогов сходных по возрасту (четырехмесячные крысы), физиологическому состоянию, питанию и поведению, находившиеся в пределах физиологической нормы животных, живой массе (от 200 до 250 грамм), пол лабораторного животного – самцы.
Крысы являются одними из основных экспериментальных систем в биологических и медицинских исследованиях. За долгие годы были выведены специальные лабораторные крысы. Благодаря быстрому метаболизму, неагрессивности и неприхотливости они до сих пор остаются одним из основных объектов во многих отраслях биологии.
Область использования: токсикологические исследования, изучение вопросов питания, стандартизация гормональных препаратов, различные исследования, а также изучение опухолей и инфекционных заболеваний.
Так как механизм передачи сальмонеллеза является фекально-оральным, а основной путь передачи – пищевым, то очагами воспаления этого заболевания являются селезенка, печень.
Для решения поставленной задачи использовали метод определения КОЕ исследуемых микроорганизмов в фекалиях на протяжении всего эксперимента (с 1 по 12 сутки исследования).
Перед проведением количественных высевов определяли массу образца(ов) из каждой группы и помещали их в пробирки Эппендорф, содержащие изотонический раствор хлорида натрия в объеме, соответствующем весу образца. Далее производилась гомогенизация на приборе TissueLyser LT (QIAGEN – фирма производитель) с использованием металлических шариков при 20 оборотах/мин в течение 30 секунд. Затем мы проводили осаждение непереваренных остатков пищи на приборе Вортекс. После осаждения отбирали надосадочную жидкость, которую высевали на среду Плоскирева в чашках Петри, в разведениях с 10-1 по 10-4.
После инкубации чашек Петри с посевом суспензий фекальных масс в течение суток при температуре 37 °С определяли число выросших колоний и подсчитывали количество КОЕ.
Определение КОЕ патогенных бактерий в крови и органах-мишенях (печень и селезенка) лабораторных животных определяли следующим образом. Клетки бактерий выращивали на среде LB (Luria-Bertani), содержащей на один литр: 10 г пептона, 5 г дрожжевого экстракта, 10 г NaCl, рН 7,5, в термостатируемом шейкере-инкубаторе IS-971R «JEIO TECH», Корея при 160 оборотах/мин и 28 °С. При необходимости в среды добавляли канамицин в концентрации 34 мкг/мл. В качестве инокулята использовали культуры стационарной фазы роста c оптической плотностью клеточной суспензии – 0,3 оптических единиц и длиной волны 600 нм.
Штаммы бактерий Salmonella typhimurium вводили перорально в дозе 5 × 108 КОЕ/мл. Убой животных производили на 3, 6, 9 и 12 сутки после заражения путем декапитации, предварительно усыпляя диэтиловым эфиром. Забор крови осуществляли путем сбора с места зареза для последующего изучения биохимических показателей.
Вскрытие производилось следующим образом. Труп животного переворачивали на спину, лапы растягивали и фиксировали, шерсть передней половины туловища обрабатывали дезинфектантом, делали ножницами продольный разрез вдоль белой линии живота к конечностям. Кожу отпрепаровывали скальпелем. Вскрывали брюшную полость от разреза под линией диафрагмы до лонной кости, заменив инструменты. В качестве материала, содержащего бактерии, из брюшной полости забирали кусочки печени и селезенки.
Отобранные органы помещали в стерильную ступку, тщательно растирали пестиком, добавляли стерильный физиологический раствор и смешивали в гомогенную суспензию. Количество физиологического раствора зависит от взвешенного кусочка органа. Полученную суспензию дозатором помещали на среду ЭНДО и шпателем Дригальского растирали до полного впитывания. Посевы инкубировали при 37 °С в течение 24 ч. После этого производили учет результатов выросших колоний. На среде ЭНДО колонии Salmonella typhimurium имели вид нежно-розовых колоний.
На первом этапе нашего исследования мы проводили отбор фекалий для бактериологического анализа и делали высевы из разведений на среду Плоскирева.
По данным графика видно, что пиковая концентрация в группе, где применялся штамм S.typhimurium 14028S с удаленным геном ΔluxS (О2), была достигнута на первый день эксперимента, в группе же, где в качестве инфекционного агента применялся дикий штамм S. typhimurium 14028S WT (О1), максимальная концентрация достигалась на вторые сутки исследования. В дальнейшем концентрация в обеих опытных группах снижалась: в группе О1 минимальная концентрация фиксировалась на шестые сутки, вплоть до 12 дня эксперимента она находилась в пределах минимума; в группе О2 снижение концентрации было плавным, минимальное ее значение достигалось только на 12 сутки.
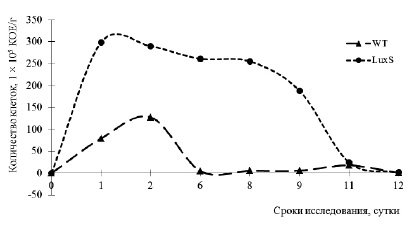
Динамика изменения КОЕ в фекалиях экспериментальных животных
Исходя из выше изложенного, можно сделать предположение о том, что в организме лабораторных животных в первые сутки шло активное размножение микроорганизмов с дальнейшей активацией процессов иммунной системы.
Изменение уровня патогенности и вирулентности различных микроорганизмов связано с различными факторами окружающей и внутренней среды макроорганизма, а также обусловлены мутациями уже хорошо изученных штаммов микроорганизмов. В данной работе было рассмотрено влияние на организм дикого Salmonella typhimurium 14028S WT и генномодифицированного штаммов Salmonella typhimurium 14028S с удаленным геном ΔluxS по средству оценки показателей крови экспериментальных животных, а также на основании выделения микроорганизмов из внутренних органов и фекалий. Проведенные исследования позволили сделать следующий вывод: установлено, что оба исследуемых штамма – Salmonella typhimurium 14028S WT и Salmonella typhimurium 14028S Δ luxS приводят к развитию генерализованной инфекции с максимальным поражающим эффектом на 6 день исследования, о чем свидетельствует выделение вышеперечисленных микроорганизмов из крови, печени, селезенки и фекалий.

