Гранат обыкновенный (Punica granatum L.) сем. Дербенниковые (Lythraceae) имеет тысячелетнюю историю использования, как в народной, так и официальной медицине. Все части этого растения, а особенно плоды, содержат комплекс ценных веществ с выраженной биологической активностью. Основной группой биологически активных соединений граната являются полифенольные соединения, представленные гидролизуемыми танинами и эллаготанинами (энотеин, пуникалин, пуникалагин, пуникакортеин и др.), флавоноидами (кемпферол, кверцетин, апигенин, лютеолин и др.), катехинами, антоцианами (дельфинидин, цианидин), фенолкарбоновыми кислотами (галловая, эллаговая и кофейная кислоты) оказывающими выраженное антиоксидантное, антибактериальное, противогрибковое, антиканцерогенное, противовоспалительное, фотопротекторное действие и другие виды активности [1, 2, 3, 4].
Перикарпий плода граната составляет около 50 % от общего веса плода и является отходом при получении гранатового сока. Однако перикарпий содержит намного больше соединений фенольного характера, чем гранатовый сок и представляет интерес как источник биологически активных веществ для создания фармацевтических препаратов, биологически активных добавок и лечебной косметики, обладающих антиоксидантным действием. Изучение влияния концентрации водно-спиртовых растворов на количественное содержание суммы полифенольных соединений и их антиоксидантную активность представляет большой интерес при выборе экстрагента для получения фитопрепаратов.
Цель данного исследования заключалась в оценке антиоксидантной активности (АОА) водно-спиртовых извлечений перикарпия плода граната (Punica granatum L.) полученных с различной концентрацией этанола.
Материалы и методы. Плоды коммерческих сортов граната приобретены в торговой сети г. Кемерово. Средний вес плода составил 420±54 г. Перикарпий плода граната, после удаления семян, сушили при температуре 30–35оС в течение 24 часов. Высушенный перикарпий измельчали до размера частиц проходящих сквозь сито с размером 0,5 мм. Порошок измельченного перикарпия хранили в темном сухом прохладном месте.
Все реактивы и растворители имели квалификацию «хч» и «чда».
Извлечения из перикарпия плода граната получали с использованием водных растворов этилового спирта с концентрацией 30, 40, 50,60 и 70 % методом мацерации в течение 10 дней. Для исследования АОА извлечения концентрировали до водного остатка и высушивали в вакууме. Определение влажности проводили согласно методике ОФС 1.2.1.0010.15 «Потеря в массе при высушивании» ГФ XIII. Качественные реакции на полифенольные соединения проводили общепринятыми методами [5].
Спектрофотометрическое определение суммы полифенольных соединений методом Folin-Ciokalteu. Для определения суммарного содержания полифенольных соединений в экстрактах перикарпия граната использован метод спектрофотометрии, основанный на восстановлении смеси фосфорновольфрамовой и фосфорномолибденовой кислот в щелочной среде по методике 2 ОФС.1.5.3.0008.15 «Определение содержания дубильных веществ в лекарственном растительном сырье и лекарственных растительных препарата». Расчет количественного содержания суммы полифенольных соединений проведен в пересчете на галловую кислоту.
Около 0,05 г полученных экстрактов (точная навеска) помещали в мерную колбу вместимостью 50 мл, растворяли в 50 % этаноле и доводили объем раствора до метки тем же растворителем. 5 мл полученного раствора помещали в мерную колбу на 50 мл и доводили объем до метки 50 % этанолом (раствор А). 2 мл раствора А помещали в мерную колбу вместимостью 25 мл, добавляли 1 мл фосфорномолибденововольфрамового реактива, 10 мл воды и доводили объем раствора до метки 10,6 % раствора натрия карбоната. Через 30 минут измеряли оптическую плотность испытуемого раствора при длине волны 760 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения 50 % этанол.
Параллельно измеряли оптическую плотность стандартного раствора галловой кислоты. 0,05 г галловой кислоты (точная навеска) помещали в мерную колбу вместимостью 100 мл, растворяли в воде и доводили объем раствора до метки. 5 мл полученного раствора помещали в мерную колбу на 100 мл и доводили объем до метки водой (стандартный раствор).
Содержание суммы полифенольных соединений (Х %) в экстрактах определяли по формуле:
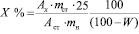 ,
,
где Ах – оптическая плотность исследуемого раствора; Аст – оптическая плотность стандартного раствора галловой кислоты; mст – масса навески галловой кислоты, г, W – потеря в массе при высушивании, %.
Антиоксидантную активность определяли спектрофотометрическим DPPH- методом [6], основанным на взаимодействии веществ, проявляющих антиоксидантную и антирадикальную активность со стабильным хромоген-радикалом 2,2–дифенил-1–пикрилгидразилом (DPPH). Готовили серию разведений из полученных извлечений с содержанием от 5 до 150 мкг/ мл, объем каждого образца доводили до 1 мл 50 % этанолом и добавляли 4 мл рабочего раствора DPPH. Раствор перемешивали и через 30 минут измеряли оптическую плотность раствора при длине волны 517 нм. В качестве контрольного образца использовали рабочий раствор DPPH.
Антиоксидантную активность определяли по формуле:
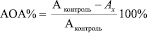 ,
,
где Ах – оптическая плотность исследуемого раствора, Аконтроль – оптическая плотность контрольного образца.
Спектрофотометрические исследования проводили на фотометре КФК-3 (Россия) в кварцевых кюветах с толщиной поглощающего слоя 10 мм.
Все измерения выполнены в трехкратной повторности. Статистическую обработку результатов измерения проводили согласно требованиям ОФС.1.1.0013.15 «Статистическая обработка результатов эксперимента». Корреляционный анализ выполнен с применением стандартной программы Microsoft Office Excel 2010.
Результаты и обсуждение. Все полученные извлечения представляли собой густые вязкие массы красновато-коричневого цвета с содержанием влаги не более 25 %. При проведении фитохимического анализа с помощью качественных реакций во всех исследуемых извлечениях были обнаружены гидролизуемые танины, эллаготанины, катехины, антоцианы и флавоноиды.
Результаты определения содержания суммы полифенольных соединений в изучаемых извлечениях приведены в табл. 1. Как видно из полученных данных, концентрация этанола незначительно влияет на процесс экстакции полифенолов, однако наибольшей экстрагирующей способностью обладает 40 % этанол. Использование этого экстрагента позволяет повысить выход полифенолов из перикарпия плода граната до 22 %.
Для определения АОА извлечений из перикарпия плода граната применялся статический метод DPPH [6]. Для каждого извлечения был построен график зависимости АОА от концентрации (мкг/мл) и проведен корреляционный анализ (табл. 1).
Таблица 1
Содержание полифенольных соединений и антиоксидантная активность извлечений из перикарпия граната
|
Экстрагент |
Содержание полифенольных соединений, X % |
Уравнение парной линейной регрессии y = b + ax |
Коэффициент корреляции r |
IC50, мкг/мл |
|
30 % этанол |
21,28±0,32 |
y = 33,59 + 0,505x |
0,984 |
32,49±1,42 |
|
40 % этанол |
24,00±0,12 |
y = 41,89 + 0,357x |
0,987 |
22,72±3,51 |
|
50 % этанол |
19,65± 0,23 |
y = 34,06 + 0,442x |
0,975 |
36,06±4,35 |
|
60 % этанол |
20,36±0,01 |
y = 22,83 + 0,820x |
0,929 |
33,13±2,47 |
|
70 % этанол |
22,14±0,10 |
y = 21,04 + 1,006x |
0,984 |
28,79±1,68 |
Величиной АОА изучаемых извлечений была выбрана концентрация, приводящая к ингибированию 50 % радикалов DPPH – IC50. Показано, что извлечение из перикарпия граната, полученное с помощью 40 % этанола, обладает большей АОА. Его IC50 превышает значения, полученные для других извлечений от 28 % до 58 %.
Таким образом, исходя из результатов исследования, установлено, что для получения фитопрепаратов из перикарпия плода граната с высоким содержанием полифенольного комплекса и выраженной АОА следует использовать 40 % этанол.
Библиографическая ссылка
Окатьева В.Е., Мальцева Е.М. ВЛИЯНИЕ КОНЦЕНТРАЦИИ ЭТАНОЛА НА АНТИОКСИДАНТНУЮ АКТИВНОСТЬ ИЗВЛЕЧЕНИЙ ИЗ ПЕРИКАРПИЯ ПЛОДА ГРАНАТА ОБЫКНОВЕННОГО (PUNICA GRANATUM L.) // Международный студенческий научный вестник. – 2018. – № 4-4. ;URL: https://eduherald.ru/ru/article/view?id=18846 (дата обращения: 23.04.2024).

