В последние годы популяция стволовых клеток жировой ткани рассматриваются в качестве альтернативы стволовых клеток красного костного мозга. Известно, что жировая ткань превосходит костный мозг по количеству стволовых клеток (СК), по их жизнеспособности и по технически более простому способу получения. Кроме того, СК жировой ткани имеют огромный регенеративный потенциал.
Так, в красном костном мозге взрослого человека на 50 000 – 1 000 000 клеток приходится всего 1 мезенхимальная стволовая клетка, а в жировои? ткани содержание СК составляет 1 на 30–1000 клеток [9].
Из 1 мл жира сразу после забора выделяется около 1 млн СК, через 2 часа — 500 тыс., и спустя 18 часов хранения жира при 4 ºС выделяется около 250 тыс.. Однако, несмотря на разные сроки выделения клеток, их жизнеспособность будет составлять 90–98 %. СК жировой ткани получают без негативного влияния на их количество, функциональную активность и жизнеспособность. У каждого человека есть большой запас СК для лечения, так как в норме жировая ткань составляет до одной четверти массы тела у женщин, и до одной пятой у мужчин.
СК жировой ткани в литературе принято называть ADSC (Adipose Derived Stem Cells). Они входят в состав стромально-васкулярной фракции (SVF) жировой ткани, включающей в себя смесь из различных клеток, в том числе следующих мезенхиальных стволовых клеток:
– преадипоциты <10% (дифференцирование адипоцитов);
– эндотелиальные клетки <10% (ангиогенез);?
– жировые стволовые клетки <10% (дифференцирование в различные виды клеток);
– фибробласты <5% (формирование экстрацеллюлярного матрикса);
– перициты <5% (стабилизация кровеносных сосудов);
– моноциты, макрофаги <40%;
– другие клетки – 20%. [9].
Клетки SVF, располагающиеся вдоль капилляров, являются мультипотентными мезенхимальными (стромальными) стволовыми клетками.
ADSC обладают высокой пластичностью, способны дифференцироваться в хондробласты, остеобласты, фибробласты, адипоциты, миоциты, кардиомиоциты, нейроны, гепатоциты, эндотелиальные клетки и др (рисунок 1). Кроме того, ADSC способны к пролиферации вне зависимости от возраста пациента [3].
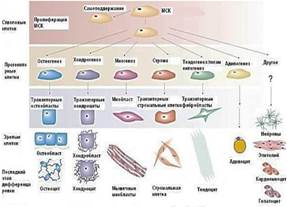
Рис. 1. Пролиферация СК жировой ткани.
Сейчас проводится много исследований терапевтического потенциала ADSC. Они касаются применения ADSC для регенерации мягких и скелетных тканей, ишемических повреждений, инфаркта миокарда, при дегенерации межпозвоночных дисков, легочных болезнях и иммунных патологий, включающих волчанку, артрит, болезнь Крона, рассеянный склероз, сахарный диабет и реакцию отторжения трансплантанта.
Показательным является регенеративный эффект трансплантированных ADSC для лечения поврежденных костей при различных дефектах. В одном из исследований на животных аутологичные ADSC были введены в головку бедренной кости. Через два месяца после операции было отмечено ускорение остеогенеза и микроструктуры, замещение костного дефекта [1].
Установлено, что in vitro ADSC могут дифференцироваться непосредственно в эпителиальные клетки или в фибробласты и могут секретировать факторы роста, которые вызывают пролиферацию и миграцию кератиноцитов, фибробластов и эндотелиальных клеток. Применение ADSC для ослабления образования гипертрофированных рубцов, которые возникают из-за аномального отложения внеклеточного матрикса (коллагена) или воспаления, было исследовано на модели гипертрофического рубца уха кроликом путем локально введённой инъекции. Это способствовало заживлению раны без образования гипертрофированного рубца [10].
Активно изучается клеточная терапия в лечении сердечно-сосудистой системы и регенерации тканей миокарда. При исследованиях на животных было выявлено, что трансплантация мезенхимальных стволовых клеток (MSCs) при лечении инфаркта миокарда (ИМ) улучшает функцию левого желудочка [8]. Изучался терапевтический потенциал ADSC при хронической сердечной недостаточности или острого инфаркта миокарда, с помощью внутрикоронарной инъекции ADSC. Через 4 недели после трансплантации клеток ADSC были отмечены улучшения сердечной функции и перфузии [6]. Кроме того, ADSC были рассмотрены как источник интерстициальных клеток для заполнения конструкций сердечного клапана. Было показано, что ADSC могут воспроизводить основные тканевые структуры, которые необходимы для надлежащей функциональности клапана, секретируя коллаген и эластин [5].
Популяции клеток стромально-васкулярной фракции жировой ткани (SVF) стимулируют образование новых кровеносных сосудов ангиогенными механизмами, обеспечивающих образование новых сосудов из уже существующих. Это происходит за счет продуцируемых ADSC факторов роста. Также они обладают васкулогенным потенциалом, то есть становится возможным формирование кровеносных сосудов de novo в постнатальном периоде. Предварительные клинические исследования с помощью клеточных маркеров дают альтернативное объяснение увеличения плотности сосудов, обработанных SVF. Установлено, что новые сосуды происходят из популяции инъецированных клеток SVF и что клетки проявляют способность самостоятельно собираться в новые сосуды: артериолы, венулы и капилляры [4]. Предполагается, что клетки SVF обеспечивают оптимальное микроокружение для реформирования многоклеточных сосудистых компонентов, включая эндотелиальные клетки, клетки гладкой мускулатуры, перициты, жировые клетки, и дополнительные иммунные и стромальные клетки.
Одним из послеоперационных осложнений является некроз участка кожи из-за недостаточного кровоснабжения. В эксперименте на различные некротические участки кожи были нанесены солевой раствор, гель стромально-васкулярной фракции (SVF-гель) и клетки стромально-васкулярной фракции. На 14 день исследования участки кожи, обработанные SVF-гелем показали наибольший регенеративный потенциал. Некроз значительно уменьшился за счет ангиогенеза. Гель стромально-васкулярной фракции получают из жирового аспирата, путем центрифугирования и экскрузии, осаждая адипоциты. С помощью этого метода получают высокую концентрацию SVF, в том числе и СК жировой ткани, без использования ферментов. Главная особенность SVF-геля - это способность локализоваться в месте инъекции, тогда как без его применения большинство клеток SVF мигрируют через 1 час после введения инъекции в мягкие ткани [7].
Изначально изучение стволовых клеток жировой ткани началось и применялось для омоложения кожи лица, рук, морщин, коррекции объема и неровностей на бедрах, ягодицах, животе и других частях тела. Так же увеличения губ, усиления роста жидких волос и реконструкции груди после мастэктомии. Эта область применения ADSC хорошо изучена, и активно применяется в регенеративной медицине.
ADSC могут быть выделены в течение часа из аспирата жировой? ткани пациента. Далее клеточная суспензия, без этапа культивирования, вновь смешивается с оставшимся жировым аспиратом и вводится пациенту. Большинство методов эстетической медицины основанных на применении стволовых клеток занимают от нескольких днеи? до недель. Необходимое количество ADSC описанным выше методом можно получить за одну хирургическую процедуру. Это позволяет проводить оперативное вмешательство достаточно быстро, и получать аутогенные СК прямо в операционной [9].
Применение ADSC для восстановления молочной железы требует особого внимания. Считается, что ADSC усиливают рост опухолевых клеток и метастазирование. Было установлено, что необлученные или с более низкими дозами облучения ADSC, улучшали рост опухолевых клеток, тогда как использование более высоких доз облучения приводило к существенному ингибированию роста опухолевых клеток (Таблица 1). Вне зависимости от дозы облучения, ADSC уменьшают выживаемость не облученных ранее опухолевых клеток. Также ADSC без предварительного облучения обеспечивают радиозащитный эффект для опухолевых клеток молочной железы, тогда как предварительно облученные не дают этого радиозащитного эффекта [2].
|
Доза облучения |
Эффект |
|
ADSC с более низкими дозами облучения или необлученные |
Активирование роста опухолевых клеток |
|
ADSC с высокими дозами облучения |
Ингибирование роста опухолевых клеток |
Табл. 1. Взаимодействие ADSC и опухолевых клеток молочной железы
При невозможности контроля окончательной дифференцировки ADSC не в опухолевые клетки необходимо рекомендовать их предварительно облучение. Трансплантированные пациенту перед радиотерапией ADSC оказывают радиозащитный эффект. Также ADSC, в зависимости от полученной дозы облучения, оказывают противоположный эффект на опухолевые клетки. Низко облученные или необлученные ADSC стимулируют рост опухолевых клеток. ADSC, получившие высокие дозы облучения перед трансплантацией ингибировали рост опухолевых клеток.
Выше сказанное подчеркивает важность дальнейших исследований влияния ADSC на рост опухоли и метастазирования при лучевой терапии.
Библиографическая ссылка
Купша Е.И., Кочина Е.В., Гордейко Т.А. Актуальные аспекты применения стволовых клеток жировой ткани в регенеративной медицине // Международный студенческий научный вестник. – 2018. – № 1. ;URL: https://eduherald.ru/ru/article/view?id=18021 (дата обращения: 27.04.2024).

